1 . 二甲醚(CH3OCH3)是一种清洁能源由合成气(CO,H2)制备二甲醚的反应原理如下:
反应Ⅰ:CO(g) +2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)⇌CH3OCH3(g) +H2O(g)△H2
回答下列问题:
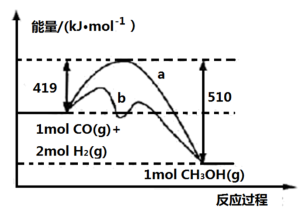
(1)上述反应符合“原子经济”原则的是____ (填“反应Ⅰ”或“反应Ⅱ”)。下图中使曲线a对应反应按曲线b进行的措施是____ ,该反应自发进行的条件为____ (填“低温”或“高温")。
(2)已知△H2=-20.0kJ ·mol-1;H2O(l)=H2O (g)△H= +44.0 kJ·mol-1,则由合成气(CO、H2)制备1 mol CH3OCH3(g),且生成H2O (l)的热化学方程式为____ ;
(3)模拟该制备原理,起始时在某容器中充入2 mol CO和4 mol H2合成CH3OCH3(g),平衡时混合物中氢气的体积分数与温度、压强的关系如下图所示。
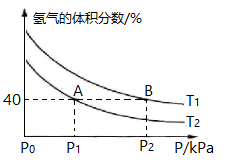
①下列有关说法能够证明恒温恒压时,反应2CO(g) +4H2(g)⇌CH3OCH3(g)+H2O (g)一定达到平衡状态的是 (填序号)___ 。
a.CO和H2的转化率相等
b.反应体系中混合气体密度保持不变
c. c(H2):c( CH3OCH3)的值保持不变
d.反应体系压强保持不变
②上图中T1____ (填“>”、“ <””或“=”,下同)T2;在A、B两点条件下,该反应从开始到平衡时生成二甲醚的平均速率:v (A)_____ v(B)。
③A点对应的CH3OCH3(g)的体积分数为_______ ,B点对应的Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
反应Ⅰ:CO(g) +2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)⇌CH3OCH3(g) +H2O(g)△H2
回答下列问题:
(1)上述反应符合“原子经济”原则的是

(2)已知△H2=-20.0kJ ·mol-1;H2O(l)=H2O (g)△H= +44.0 kJ·mol-1,则由合成气(CO、H2)制备1 mol CH3OCH3(g),且生成H2O (l)的热化学方程式为
(3)模拟该制备原理,起始时在某容器中充入2 mol CO和4 mol H2合成CH3OCH3(g),平衡时混合物中氢气的体积分数与温度、压强的关系如下图所示。

①下列有关说法能够证明恒温恒压时,反应2CO(g) +4H2(g)⇌CH3OCH3(g)+H2O (g)一定达到平衡状态的是 (填序号)
a.CO和H2的转化率相等
b.反应体系中混合气体密度保持不变
c. c(H2):c( CH3OCH3)的值保持不变
d.反应体系压强保持不变
②上图中T1
③A点对应的CH3OCH3(g)的体积分数为
您最近一年使用:0次
解题方法
2 . 下列涉及有机物结构与性质的说法错误的是
A.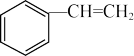 中所有原子可能共平面 中所有原子可能共平面 |
| B.乙烯易与溴水发生加成反应,且1mol乙烯完全加成需要消耗1molBr2,可证明乙烯分子里含有一个碳碳双键 |
| C.1mol乙烯与氯气完全加成后,产物再与氯气发生取代反应,则两个过程中消耗氯气的总物质的量最多是5mol |
D.有机物M(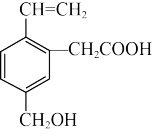 )可发生酯化反应、氧化反应、水解反应等 )可发生酯化反应、氧化反应、水解反应等 |
您最近一年使用:0次
名校
3 . 食盐中所加的碘以碘酸钾(KIO3)形式存在。根据反应:IO +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO 。下列说法不正确的是
。下列说法不正确的是
 +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO 。下列说法不正确的是
。下列说法不正确的是| A.上述反应中氧化剂和还原剂的物质的量之比为1∶5 |
| B.实验时可观察到试纸变蓝 |
| C.实验可证明该条件下I-的还原性强于Cl- |
| D.食醋中含有的乙酸是强酸,它能提供反应所需的H+ |
您最近一年使用:0次
2020-07-04更新
|
324次组卷
|
5卷引用:贵州省铜仁市伟才学校2019-2020学年高一下学期期末考试化学(理)试题
贵州省铜仁市伟才学校2019-2020学年高一下学期期末考试化学(理)试题北京市东城区北京景山学校2019~2020学年高一下学期期末考试化学试题黑龙江省大庆市肇州县第二中学2019-2020学年高一下学期期末考试化学试题(已下线)1.3.4 氧化还原反应方程式的配平-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题
4 . 2019年是门捷列夫提出元素周期表150周年,根据元素周期表和周期律,回答问题。
Ⅰ.下表显示了元素周期表中短周期的一部分,①〜⑥代表6种短周期元素。其中②与氢元素形成的简单氢化物分子中含10个电子,能够使湿润的红色石蕊试纸变蓝。
(1)①在周期表中所处的位置为__________ 。
(2)与②同族的第四周期元素的原子结构示意图为__________ 。
(3)写出③与⑥的简单氢化物中沸点较高的分子的电子式__________ 。
(4)④的单质与水反应的离子方程式为__________ 。
(5)工业制取⑤的单质的化学方程式为__________ 。
Ⅱ.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。
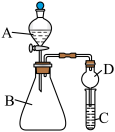
(6)干燥管D的作用是__________ 。
(7)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液观察到C中溶液变蓝,则C试管中发生反应的离子方程式为__________ 。
(8)证明非金属性:N>C,在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液__________ 的现象,该实验设计的原理是利用最高价氧化物对应水化物的酸性强弱来比较元素非金属性的强弱。
Ⅲ.到目前为止,元素周期表的第七周期已经被填满。
(9)请你设想一下,如果发现120号元素,下列有关它在周期表的位置或性质的说法错误的两项是__________ 。
①在第八周期ⅡA族;②最外层电子数是2;③比钙的熔点高;④与水反应放出氢气但比钙缓慢;⑤该元素单质需隔绝空气密封保存;⑥该元素的氧化物属于离子化合物
Ⅰ.下表显示了元素周期表中短周期的一部分,①〜⑥代表6种短周期元素。其中②与氢元素形成的简单氢化物分子中含10个电子,能够使湿润的红色石蕊试纸变蓝。
① | ② | ③ | ||||
④ | ⑤ | ⑥ |
(2)与②同族的第四周期元素的原子结构示意图为
(3)写出③与⑥的简单氢化物中沸点较高的分子的电子式
(4)④的单质与水反应的离子方程式为
(5)工业制取⑤的单质的化学方程式为
Ⅱ.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。

(6)干燥管D的作用是
(7)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液观察到C中溶液变蓝,则C试管中发生反应的离子方程式为
(8)证明非金属性:N>C,在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液
Ⅲ.到目前为止,元素周期表的第七周期已经被填满。
(9)请你设想一下,如果发现120号元素,下列有关它在周期表的位置或性质的说法错误的两项是
①在第八周期ⅡA族;②最外层电子数是2;③比钙的熔点高;④与水反应放出氢气但比钙缓慢;⑤该元素单质需隔绝空气密封保存;⑥该元素的氧化物属于离子化合物
您最近一年使用:0次
2019-08-04更新
|
197次组卷
|
2卷引用:山东省聊城市莘县第一中学2018-2019学年高一下学期期末考试化学试题
2014·全国·一模
解题方法
5 . 下列说法中可以证明反应H2(g)+I2(g) 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是
①单位时间内生成nmol H2的同时生成nmol HI;②一个H-H键断裂的同时有两个H-I键断裂;③百分含量w(HI)=w(I2);④反应速率v(H2)=v(I2)=v(HI);⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1;⑥温度和体积一定时,生成物浓度不再变化;⑦温度和体积一定时,容器内的压强不再变化;⑧条件一定时,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化
 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是①单位时间内生成nmol H2的同时生成nmol HI;②一个H-H键断裂的同时有两个H-I键断裂;③百分含量w(HI)=w(I2);④反应速率v(H2)=v(I2)=v(HI);⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1;⑥温度和体积一定时,生成物浓度不再变化;⑦温度和体积一定时,容器内的压强不再变化;⑧条件一定时,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化
| A.①②③④ | B.②⑥⑨ | C.②⑥⑨⑩ | D.③⑤⑥⑦⑧ |
您最近一年使用:0次
2019-01-30更新
|
375次组卷
|
4卷引用:贵州省长顺县二中2019-2020学年高二上学期期末考试化学试题
贵州省长顺县二中2019-2020学年高二上学期期末考试化学试题(已下线)2014高考名师推荐化学化学平衡的标志2016届福建省三明一中高三上学期第二次月考化学试卷2015-2016学年湖北省宜昌市示范高中高二下期中化学试卷
名校
6 . 将SO2分别通入下列4种溶液中,有关说法正确的是

| A.试管a中实验可以证明SO2具有漂白性 |
| B.试管b中溶液褪色,说明SO2具有强氧化性 |
| C.试管c中能产生白色沉淀,该沉淀的成分为BaSO3 |
| D.试管d中能产生白色沉淀,该沉淀完全溶于稀盐酸 |
您最近一年使用:0次
2018-01-31更新
|
418次组卷
|
5卷引用:贵州省六盘水市六枝特区七中2018-2019学年高一上学期期末考试化学试题
名校
7 . 在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
| A.②③④ | B.①③⑤ | C.①④⑤ | D.③④⑤ |
您最近一年使用:0次
2017-12-28更新
|
173次组卷
|
3卷引用:贵州省遵义市第四中学2017-2018学年高二上学期第二次月考化学试题
贵州省遵义市第四中学2017-2018学年高二上学期第二次月考化学试题【全国百强校】贵州省贵阳市第一中学2018-2019学年高二上学期第一次月考化学试题(已下线)黄金30题系列 高二化学(选修4) 小题易丢分
名校
8 . 某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是


| A.①和②中发生的反应均为复分解反应 |
| B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 |
| C.一段时间后②中有胶冻状物质生成 |
| D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 |
您最近一年使用:0次
2016-12-09更新
|
251次组卷
|
11卷引用:贵州省遵义航天高级中学2017-2018学年高一上学期期末考试理科综合化学试题
贵州省遵义航天高级中学2017-2018学年高一上学期期末考试理科综合化学试题2015-2016学年北京市西城区高一上学期期末考试化学试卷2016-2017学年广东省汕头市金山中学高一上学期期末考试化学试卷(已下线)北京市第四中学2016-2017学年高一下学期期中考试化学试题安徽省定远重点中学2018-2019学年高一下学期开学考试化学试题云南省漾濞二中2019-2020学年高二上学期开学考试化学试题安徽省合肥市肥东县高级中学2019-2020学年高一上学期期末考试化学试题安徽省滁州市民办高中2019-2020学年高一上学期期末考试化学试题四川省绵阳中学实验学校2019-2020学年高一下学期入学考试化学试题 甘肃省玉门市油田第一中学2020-2021学年高一上学期期末考试化学试题云南省玉溪师范学院附属中学2022-2023学年高一下学期期末考试化学试题
14-15高一上·甘肃天水·期中
名校
9 . 下列说法中正确的是
| A.某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B.能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D.H++OH-=H2O可描述所有酸碱中和反应的实质 |
您最近一年使用:0次
2016-12-09更新
|
1233次组卷
|
15卷引用:【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题
【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题贵州省黄平县第二中学2018-2019学年高一上学期12月月考化学试题(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷湖北省沙市中学2017-2018学年高一上学期第四次双周考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高一上学期期中考试化学试题云南省元江县一中2020届高三上学期开学考试化学试题云南省河口县一中2019-2020学年高二上学期开学考试化学试题第2章《元素与物质世界》期中复习检测试卷云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题吉林省白城市第一中学2019-2020学年高一上学期期中考试化学试题湖南省长沙市长沙县第六中学2020届高三上学期第二次月考化学试题(已下线)第09练 离子反应-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高一上学期第一次月考化学试题
10 . 甲同学认为Ca(OH)2与CO2能反应,而NaOH与CO2不能反应,因为实验室检验CO2用澄清石灰水而不用NaOH溶液。乙同学认为甲同学的说法不完全正确。乙同学怎么通过实验证明自己的观点呢?请你与乙同学一起在实验室完成以下实验。
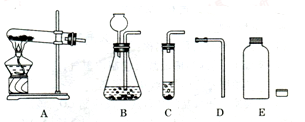
【提出假设】NaOH溶液与CO2能反应。
【设计方案】(1)常用 和 反应制取CO2气体;
(2)请从如图所示的实验装置中选出正确的制取装置 (填字母),不选择其它发生装置的理由是 。
(3)验证假设:
所以,假设成立。
(4)【总结与反思】丙同学认为还应该做一个对比实验,其理由是 。

【提出假设】NaOH溶液与CO2能反应。
【设计方案】(1)常用 和 反应制取CO2气体;
(2)请从如图所示的实验装置中选出正确的制取装置 (填字母),不选择其它发生装置的理由是 。
(3)验证假设:
| 实验步骤 | 实验现象 | 结论 |
| 第一步:向集满CO2的塑料瓶中注入少量NaOH溶液,立即旋好盖子,振荡 | NaOH溶液吸收了塑料瓶中的CO2气体 | |
| 第二步:取上一步中所得溶液,加入盐酸 | 有关反应的化学方程式为 |
(4)【总结与反思】丙同学认为还应该做一个对比实验,其理由是 。
您最近一年使用:0次



