11-12高三·北京·阶段练习
名校
1 . 过氧化氢俗称双氧水,为运输、使用的方便,工业常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3.3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是
| A.MnO2 | B.H2S | C.稀盐酸 | D.NaHCO3 |
您最近一年使用:0次
2023-08-26更新
|
254次组卷
|
12卷引用:江苏省2001年高中学生化学奥林匹克竞赛(初赛)试题
江苏省2001年高中学生化学奥林匹克竞赛(初赛)试题(已下线)2013届北京市北师特学校高三第二次月考化学试卷(已下线)2012-2013学年湖北省沙市中学高一第六次周考化学试卷2016-2017学年天津市部分区高一上学期期末化学试卷河南省商丘市第一高级中学2017-2018学年高一上学期第二次月考化学试题人教版(2019)高一必修第一册 第二章 第一节综合训练天津市部分区2020-2021学年高一上学期期中考试化学试题江西省赣州市信丰中学2020-2021学年高三上学期第二次月考化学试题辽宁省鞍山市岫岩满族自治县高级中学2021-2022学年高三下学期期中质量检测化学试题云南省昭通市盐津县第三中学2021-2022学年高一上学期12月考试化学试题辽宁省大连市第八中学2022-2023学年高三上学期10月月考化学试题浙江金华第一中学2023-2024学年高一上学期10月月考化学试题
9-10高二·山东·假期作业
名校
解题方法
2 . 某溶液中含有HCO 、SO
、SO 、CO
、CO 、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
 、SO
、SO 、CO
、CO 、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)| A.CH3COO- | B.SO | C.CO | D.HCO |
您最近一年使用:0次
2021-11-09更新
|
865次组卷
|
48卷引用:江苏省2001年高中学生化学奥林匹克竞赛(初赛)试题
江苏省2001年高中学生化学奥林匹克竞赛(初赛)试题(已下线)2010年安丘中学高二暑期练习化学卷(六)(已下线)2010—2011学年福建省安溪一中、养正中学高二下学期期末联考化学试卷(理)(已下线)2012届河南省焦作十一中高三第一次月考化学试卷(已下线)2011-2012学年内蒙古巴彦淖尔市中学高二期中考试化学试卷(已下线)2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷(已下线)2015届吉林省公主岭市第一中学高三上学期第二次月考化学试卷2014-2015湖北省武汉华中师大附高一上学期期末化学试卷2016届河北省冀州市中学高三复习班上第一次月考化学试卷A2016届江西师大附中,九江一中高三上期中化学试卷2016届安徽省合肥一六八中学高三上第四次段考化学试卷2016届山东省枣庄三中高三上学期12月质检化学试卷2016届北京一五六中学上学期高三期中考试化学试卷2016届江西省上饶市余干二中高三上学期教学质检化学试卷2015-2016学年湖北沙市中学高一下第一次半月考化学试卷2016届湖南省邵阳市第一中学高三上学期第一次月考化学试卷2017届河北省定州中学高三上第一次月考化学试卷陕西省西安市长安区第一中学2017-2018学年高一上学期期末考试化学试题浙江省东阳中学2018-2019学年高一上学期12月月考化学试题内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期期末考试化学试题福建省龙岩市连城县第一中学2020届高三上学期第一次月考化学试题甘肃省武威第十八中学2020届高三上学期第二次诊断考试化学试题吉林省蛟河市友好学校2019-2020学年高一上学期期中联考化学试题辽宁省大连市2019-2020学年高一上学期期中考试化学试题江西省宜春市靖安中学2019-2020学年高二上学期第二次月考化学试题(已下线)考点07 元素化合物综合——《备战2020年高考精选考点专项突破题集》河北省衡水市阜城中学2019-2020高一上学期期中考试化学(人教版)试题(已下线)【新东方】 2020-33海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题江西省宜春市奉新县冶城职业学校(奉新县第三中学)2020-2021学年高三上学期第四次月考化学试题山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题(已下线)衔接点14 钠的化合物-2021年初升高化学无忧衔接山东省潍坊第四中学2021-2022学年高三上学期10月月考化学试题山东省潍坊市昌乐二中2021-2022学年高三10月月考化学试题陕西省西安市第一中学2022届高三上学期期中考试化学试题重庆市南开中学校2021-2022学年高一上学期阶段性测试化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期期中考试化学试题(已下线)衔接点15 钠的化合物-2022年初升高化学无忧衔接?(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期期末线上测试化学试题吉林省长春市东北师范大学附属中学2022-2023学年高一上学期期中考试化学试题湖南省邵阳市隆回县第二中学2022-2023学年高一上学期期中考试化学试题福建师范大学附属中学2022-2023学年高一下学期开学阶段考试化学试题黑龙江省哈尔滨市2023-2024学年师大附中高一上学期化学期中测试黑龙江省哈尔滨师范大学附属中学2023-2024学年高一上学期11月期中化学试题黑龙江省牡丹江市第二高级中学2023-2024学年高三上学期第三次阶段性考试化学试题黑龙江省哈尔滨师范大学附属中学202-2024学年高一上学期期中考试化学试卷
3 . 氢键可以表示为A—H…B,其产生的条件是A电负性大,它强烈地吸引氢的电子云(或者说增强H的酸性),受体B具有能与酸性氢原子强烈地相互作用的高电子云密度区(如孤对电子)。
(1)分子官形成的氢键会使化合物的熔、沸点_______ ;分子内形成氢键会使化合物的熔、沸点_______ 。
(2)在极性溶剂中,溶质和溶剂的分子间形成氢键会使溶质的溶解度_______ (填“增大”或“减小”);溶质的分子内形成氢键时,在极性溶剂中溶质的溶解度将_______ (填“增大”或“减小”);在非极性溶剂中溶质的溶解度将_______ (填“增大”或“减小”)。
(3)由于形成氢键,氯仿在苯中的溶解度明显比1,1,1—三氯乙烷的大,请用文字或图示描述上述氢键_______ 。
(1)分子官形成的氢键会使化合物的熔、沸点
(2)在极性溶剂中,溶质和溶剂的分子间形成氢键会使溶质的溶解度
(3)由于形成氢键,氯仿在苯中的溶解度明显比1,1,1—三氯乙烷的大,请用文字或图示描述上述氢键
您最近一年使用:0次
4 . ZnSe是一种光电性能优异的II~VI族半导体材料,人们开发出了多种制备ZnSe纳米粒子的方法。某研究小组用如下方法制备了ZnSe纳米粒子。
①将1mmol的Zn(NO3)2·6H2O溶于去离子水中形成无色澄清溶液,往该溶液中加入1mmolSeO2,超声完全溶解后形成无色澄清溶液;
②再加入过量的水合肼(N2H4·H2O),超声几分钟后将溶液转移到内衬聚四氟乙烯套的不锈钢高压反应釜中,将高压反应釜拧紧密封后放在160°C的恒温干燥箱中保温12小时(已知肼有强还原性,Se在碱性条件下可发生岐化反应);
③反应结束后自然冷却至室温,得到淡黄色沉淀,将产物用蒸馏水和无水乙醇洗涤数次,干燥后得到产物。将产物用X-射线粉末衍射仪(XRD)和X射线能谱仪进行物相和成分分析,发现其Zn和Se的原子个数比接近1:1。
(1)写出过程①中的化学方程式:_______
(2)写出过程②中的离子方程式:_______
(3)产物样品的红外光谱分析结果如图1所示,该谱图反映出产物有明显的N-H、N-N吸收峰。这是因为产物中可能含有:_______ 。
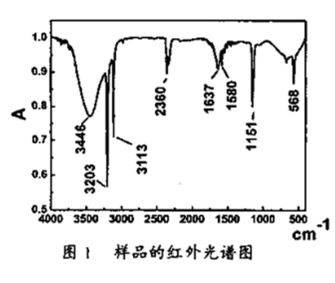
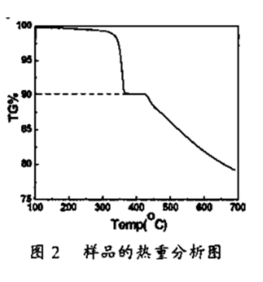
(4)产物样品的热重(重量-温度关系图)分析结果如图2所示,根据图1和图2提供的信息,推测产物的化学式可能为:_______ 。
①将1mmol的Zn(NO3)2·6H2O溶于去离子水中形成无色澄清溶液,往该溶液中加入1mmolSeO2,超声完全溶解后形成无色澄清溶液;
②再加入过量的水合肼(N2H4·H2O),超声几分钟后将溶液转移到内衬聚四氟乙烯套的不锈钢高压反应釜中,将高压反应釜拧紧密封后放在160°C的恒温干燥箱中保温12小时(已知肼有强还原性,Se在碱性条件下可发生岐化反应);
③反应结束后自然冷却至室温,得到淡黄色沉淀,将产物用蒸馏水和无水乙醇洗涤数次,干燥后得到产物。将产物用X-射线粉末衍射仪(XRD)和X射线能谱仪进行物相和成分分析,发现其Zn和Se的原子个数比接近1:1。
(1)写出过程①中的化学方程式:
(2)写出过程②中的离子方程式:
(3)产物样品的红外光谱分析结果如图1所示,该谱图反映出产物有明显的N-H、N-N吸收峰。这是因为产物中可能含有:

(4)产物样品的热重(重量-温度关系图)分析结果如图2所示,根据图1和图2提供的信息,推测产物的化学式可能为:

您最近一年使用:0次
5 . 具有独特的P、N杂化结构和突出的热学、电学性能的环境友好的磷腈化合物是目前无卤阻燃研究的热点之一,尤其是HPCTP更引起人们的关注。HPCTP的合成路线如下:
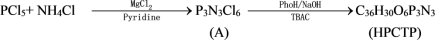
Pyridine、TBAC和PhOH分别为吡啶、四丁基溴化铵和苯酚。HPCTP的红外光谱表明分子中存在P-N、P-O-C、P= N的吸收峰以及单取代苯环的特征峰; HPCTP 的核磁共振磷谱表明分子中只有1种化学环境的磷;X射线衍射分析表明A和HPCTP分子结构均具有很好的对称性。
(1)分别写出化合物A、HPCTP的结构式:A_______ ,HPCTP_______ 。
(2)化合物 A反应生成HPCTP的反应类型是_______ 。
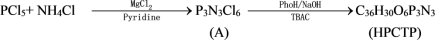
Pyridine、TBAC和PhOH分别为吡啶、四丁基溴化铵和苯酚。HPCTP的红外光谱表明分子中存在P-N、P-O-C、P= N的吸收峰以及单取代苯环的特征峰; HPCTP 的核磁共振磷谱表明分子中只有1种化学环境的磷;X射线衍射分析表明A和HPCTP分子结构均具有很好的对称性。
(1)分别写出化合物A、HPCTP的结构式:A
(2)化合物 A反应生成HPCTP的反应类型是
您最近一年使用:0次
6 . 随着哥本哈根气候大会的结束,气候变暖牵动全球,“低碳生活”渐人人心。世界各国也纷纷将发展解决化石能源危机和缓解环境污染问题的绿色能源作为21世纪的国家战略之一。 氢能是最为理想的能源之一, 氢能的发展最关键的技术难题是氢的储存。在储氢材料研究领域,新加坡国立大学Ping Chen等人的研究成果成为一 个重要的里程碑,他们在《Nature》上撰文,宣布Li3N可以作为一种新型无机贮氢材料,并指出Li3N的吸氢反应过程按如下两步进行:
Li3N(s) +H2(g)⇌Li2NH(s)+ LiH(s) (1)
Li2NH(s) +H2(g)⇌LiNH2(s) + LiH(s) (2)
在这两步,反应中,四种固体化合物之间的转化也伴随着四种不同的晶体结构之间的转化。
(1)LiH属于立方晶系,晶胞参数a= 4.075A。晶体中H原子作A1堆积,A、B、C表示H的堆积层,a、b、c表示Li的堆积层,那么LiH沿正当晶胞体对角线方向的堆积周期是| AcBaCb |。则: LiH的晶胞类型是_______ ;请画出LiH正当晶胞沿着体对角线方向的投影(用实线圆圈“ ”表示H的投影,用虚线圆圈“
”表示H的投影,用虚线圆圈“ ”表示Li的投影,如投影重合则用“
”表示Li的投影,如投影重合则用“ ”表示,每种原子不少于7个)
”表示,每种原子不少于7个) _______ 。
(2)Li2NH 是吸氢反应过程中的关键产物,确定Li2NH晶体中各原子的存在状态是揭示其储氢机理和对该类材料进行改进的关键。实验已经确定Li以正离子Li+形式存在。然而,由于目前实验手段的限制,H的位置很难准确确定,因而Li2NH的结构前还存在争议。现在普遍认可的是日本学者Noritake等利用同步加速器X-射线衍射方法测得的结构:Li2NH属于立方晶系,晶胞参数a= 5.074Å ;N和H的原子坐标:N(0.00,0.00,0.00),H(0.11,0.11,0.00)。已知H和N的共价半径分别为0.37Å和0.74Å,试通过计算说明Li2NH中N和H的存在状态_______ 。
(3)若Li2NH晶体中Li填充在四面体空隙中,并采取简单立方堆积,则Li2NH与常见的_______ 晶体的结构相似,且做出上述推断的前提是Li2NH晶体中N、H为_______ 结构。
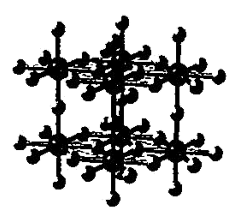
(4)α- Li3N属于六方晶系,晶体结构如图所示,据图请画出一个α- Li3N的六方晶胞(大球表示N原子,小球表示Li原子)_______ 。
(5)晶体结构测试表明:LiNH2 属于四方晶系,晶胞参数a=5.037 Å,c= 10. 278 Å,一个晶胞中包含4个LiNH2。若以材料中H的密度作为材料的储氢能力,通过计算比较Li2NH、LiH、LiNH2的储氢能力_______ 。
Li3N(s) +H2(g)⇌Li2NH(s)+ LiH(s) (1)
Li2NH(s) +H2(g)⇌LiNH2(s) + LiH(s) (2)
在这两步,反应中,四种固体化合物之间的转化也伴随着四种不同的晶体结构之间的转化。
(1)LiH属于立方晶系,晶胞参数a= 4.075A。晶体中H原子作A1堆积,A、B、C表示H的堆积层,a、b、c表示Li的堆积层,那么LiH沿正当晶胞体对角线方向的堆积周期是| AcBaCb |。则: LiH的晶胞类型是
 ”表示H的投影,用虚线圆圈“
”表示H的投影,用虚线圆圈“ ”表示Li的投影,如投影重合则用“
”表示Li的投影,如投影重合则用“ ”表示,每种原子不少于7个)
”表示,每种原子不少于7个) (2)Li2NH 是吸氢反应过程中的关键产物,确定Li2NH晶体中各原子的存在状态是揭示其储氢机理和对该类材料进行改进的关键。实验已经确定Li以正离子Li+形式存在。然而,由于目前实验手段的限制,H的位置很难准确确定,因而Li2NH的结构前还存在争议。现在普遍认可的是日本学者Noritake等利用同步加速器X-射线衍射方法测得的结构:Li2NH属于立方晶系,晶胞参数a= 5.074Å ;N和H的原子坐标:N(0.00,0.00,0.00),H(0.11,0.11,0.00)。已知H和N的共价半径分别为0.37Å和0.74Å,试通过计算说明Li2NH中N和H的存在状态
(3)若Li2NH晶体中Li填充在四面体空隙中,并采取简单立方堆积,则Li2NH与常见的
(4)α- Li3N属于六方晶系,晶体结构如图所示,据图请画出一个α- Li3N的六方晶胞(大球表示N原子,小球表示Li原子)

(5)晶体结构测试表明:LiNH2 属于四方晶系,晶胞参数a=5.037 Å,c= 10. 278 Å,一个晶胞中包含4个LiNH2。若以材料中H的密度作为材料的储氢能力,通过计算比较Li2NH、LiH、LiNH2的储氢能力
您最近一年使用:0次
7 . 替米哌隆 (Timiperone)是一种抗精神病药,主要用于治疗精神分裂症。其合成路线如下:
 A(C10H10ClFO)
A(C10H10ClFO) 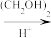 B(C12H14ClFO2)
B(C12H14ClFO2)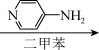 C(C17H20ClFN2O2)
C(C17H20ClFN2O2) 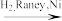
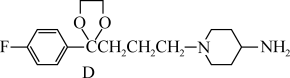
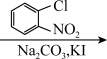
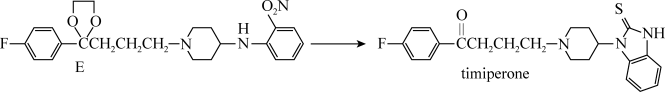
(1)写出A、B、C的结构式:A_______ 、B_______ 、C_______ 。
(2)将A转化为B的目的是:_______ 。
(3)4-氨基吡啶与B的反应中是环上的N而不是氨基N参与了反应,原因是:_______ 。
 A(C10H10ClFO)
A(C10H10ClFO) 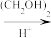 B(C12H14ClFO2)
B(C12H14ClFO2) C(C17H20ClFN2O2)
C(C17H20ClFN2O2) 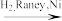
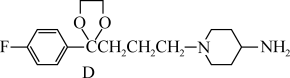


(1)写出A、B、C的结构式:A
(2)将A转化为B的目的是:
(3)4-氨基吡啶与B的反应中是环上的N而不是氨基N参与了反应,原因是:
您最近一年使用:0次
8 . 癌症是威胁人类健康的主要疾病之一。肿瘤的发病涉及到多种因素多个步骤的病理过程。研究表明,肿瘤的发生与核小体核心组蛋白N-端的赖氨酸残基的乙酰化和去乙酰化的失衡有着密切的关系。组蛋白去乙酰化酶(histone deacetylases,HDACs)抑制剂通过调节组蛋白N-端的赖氨酸残基的乙酰化和去乙酰化,激活抑癌基因,从而抑制肿瘤细胞生长,诱导肿瘤细胞凋亡,因此是近几年来抗肿瘤药物的研究热点之一。下面是一种HDAC抑制剂(F)的合成路线,请根据该路线回答问题。
(甲)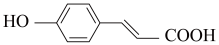
 (A)
(A)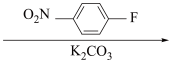 (B)
(B) (C)
(C)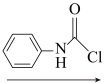 (D)
(D) (E)
(E)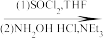 (F)
(F)
(1)写出A、B、D、E的结构式:A_______ B_______ D_______ E_______
(2)F与Zn2+配位是其发挥作用的前提之一。F中哪个部位最易与Zn2+配位?为什么_______ 。
(3)以3-(2-异丁基-4-羟基)苯基丙烯酸为原料,也可合成一种HDAC,该原料可能的立体异构体有_______ 种。
(甲)

 (A)
(A) (B)
(B) (C)
(C) (D)
(D) (E)
(E)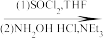 (F)
(F)
(1)写出A、B、D、E的结构式:A
(2)F与Zn2+配位是其发挥作用的前提之一。F中哪个部位最易与Zn2+配位?为什么
(3)以3-(2-异丁基-4-羟基)苯基丙烯酸为原料,也可合成一种HDAC,该原料可能的立体异构体有
您最近一年使用:0次
9 . 回答下列问题:
(1)CaC2的晶体结构如图所示,其中C-C键长为0.119nm,图中所给的晶胞_______ (填“是”或“不是”)正当晶胞。该结构有_______ 个对称面。

碱金属或碱土金属都可以和氧原子形成具有与CaC2相同结构的化合物如KO2、BaO2。若KO2、BaO2中O -O 键长、CaC2中C- C键长分别为a、b、c ,其相对大小为_______ 。
(2)以CaC2为还原剂,以MgO为原料可以炼镁,还原温度为1150°C左右,反应产物中基本没有CO,反应需抽真空进行。则该反应的化学方程式为:_______ ,产物中基本没有CO的原因是:_______ ,反应需抽真空进行的理由是:_______ 。
(3)工业上用焦炭和生石灰在2000°C左右反应制备CaC2,原料中往往含有MgO、SiO2、Fe2O3、Al2O3、S、P等杂质,这些都不利于电石的生产。其中S的存在形式一般为FeS2或硫酸盐,产品中S的主要存在形式是_______ 。
(4)欲分析电石中CaC2含量,可称取mg试样于150mL锥形瓶中,加5mL水,再加8mL硝酸(浓度c1mol·L-1)、4-5滴氢氟酸(浓度c2 mol·L-1)、5 mL高氯酸(浓度c3 mol·L-1),在电热板上加热溶解并蒸发冒白烟至试液体积约为2~3mL,取下稍冷却加15mL盐酸(浓度c4 mol·L-1)使盐类溶解后,移入250mL容量瓶中,以水稀释至刻度,摇匀。准确移取25mL试液于500mL锥形瓶中,加100mL水,10mL三乙醇胺溶液,约20mL氢氧化钾溶液调整pH≥12.5,I mL半胱胺酸溶液,5 mL硫酸镁溶液,摇匀,加钙指示剂少许.用EDTA标准溶液(浓度c mol·L-1)滴定至紫红色变蓝色为终点,用去V mL EDTA(已知EDTA与Ca2+,反应时物质的量之比为1: 1)
①写出CaC2百分含量的表达式_______ (注:表达式中只允许有一个具体的数值):
②为什么要先加5 mL水?否则将会发生什么结果_______ 。
(1)CaC2的晶体结构如图所示,其中C-C键长为0.119nm,图中所给的晶胞

碱金属或碱土金属都可以和氧原子形成具有与CaC2相同结构的化合物如KO2、BaO2。若KO2、BaO2中O -O 键长、CaC2中C- C键长分别为a、b、c ,其相对大小为
(2)以CaC2为还原剂,以MgO为原料可以炼镁,还原温度为1150°C左右,反应产物中基本没有CO,反应需抽真空进行。则该反应的化学方程式为:
(3)工业上用焦炭和生石灰在2000°C左右反应制备CaC2,原料中往往含有MgO、SiO2、Fe2O3、Al2O3、S、P等杂质,这些都不利于电石的生产。其中S的存在形式一般为FeS2或硫酸盐,产品中S的主要存在形式是
(4)欲分析电石中CaC2含量,可称取mg试样于150mL锥形瓶中,加5mL水,再加8mL硝酸(浓度c1mol·L-1)、4-5滴氢氟酸(浓度c2 mol·L-1)、5 mL高氯酸(浓度c3 mol·L-1),在电热板上加热溶解并蒸发冒白烟至试液体积约为2~3mL,取下稍冷却加15mL盐酸(浓度c4 mol·L-1)使盐类溶解后,移入250mL容量瓶中,以水稀释至刻度,摇匀。准确移取25mL试液于500mL锥形瓶中,加100mL水,10mL三乙醇胺溶液,约20mL氢氧化钾溶液调整pH≥12.5,I mL半胱胺酸溶液,5 mL硫酸镁溶液,摇匀,加钙指示剂少许.用EDTA标准溶液(浓度c mol·L-1)滴定至紫红色变蓝色为终点,用去V mL EDTA(已知EDTA与Ca2+,反应时物质的量之比为1: 1)
①写出CaC2百分含量的表达式
②为什么要先加5 mL水?否则将会发生什么结果
您最近一年使用:0次
10 . 葡萄糖是自然界分布最广且最为重要的一种单糖,它是一种多羟基醛。葡萄糖是生物体内新陈代谢不可缺少的营养物质。口服葡萄糖(ORALGLUCOSE)一般呈粉状,是最基本的医药原料,它能迅速增加入体的能量、耐力,可用作血糖过低、感冒发烧、头晕虚脱、四肢无力及心肌炎等症的补充液。葡萄糖含量的测定可用碘量法,某样品测定过程如下:称取约10.00g葡萄糖试样于100mL烧杯中,加少量水溶解后定量转移到250mL容量瓶中,定容并摇匀。用移液管吸取该试液50.00mL于250mL碘量瓶中,准确加入0.05000mol·L-1标准溶液30.00mL(过量)。在摇动下缓缓滴加1.0mol·L-1NaOH溶液,直至溶液变成浅黄色。盖上表面皿,放置约15min,使之反应完全。用少量水冲洗表面皿和碘量瓶内壁,然后加入8mL0.5mol·L-1HCl,析出的I2立即用0.1000mol·L-1Na2S2O3标准溶液滴定至浅黄色。加2mL淀粉指示剂,继续滴定至蓝色恰好消失即为终点,消耗了Na2S2O39.96mL。[M(C6H12O6)=180.2]
(1)写出下列离子反应方程式:
①碘标准溶液与NaOH溶液反应_______
②葡萄糖在碱性条件下与IO-反应_______
③硫代硫酸钠与碘反应_______
(2)该样品葡萄糖含量为_______ 。
(1)写出下列离子反应方程式:
①碘标准溶液与NaOH溶液反应
②葡萄糖在碱性条件下与IO-反应
③硫代硫酸钠与碘反应
(2)该样品葡萄糖含量为
您最近一年使用:0次



