名校
解题方法
1 . 工业生产可利用水煤气还原氧化钴得金属钴,发生的主要反应有:
I.CoO(s)+CO(g) Co(s)+CO2(g)
Co(s)+CO2(g)
II.CoO(s)+H2(g) Co(s)+H2O(g)
Co(s)+H2O(g)
同时存在副反应III.CO2(g)+H2(g) CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
回答下列问题:
(1)几种化学键的键能如表所示:
则a=____ kJ·mol-1。
(2)823K时,将0.1molH2和0.2molCO2充入1L密闭容器中,发生反应III,平衡后容器内总压强为50.66kPa,此时H2O(g)的体积分数为0.2,向容器中加入足量CoO(s)和Co(s),继续反应达平衡后容器中H2O(g)的体积分数为0.3。此时容器中H2的物质的量n(H2)=_____ ,反应II的压强平衡常数Kp2=____ ,判断823K时还原CoO(s)为Co(s)的倾向是CO____ H2(填“大于”或“小于”)。
(3)研究表明,CO2(g)+H2(g) CO(g)+H2O(g)反应速率方程为v=k[c(CO)•c(H2O)-
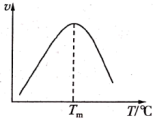
CO(g)+H2O(g)反应速率方程为v=k[c(CO)•c(H2O)-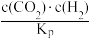 ],其中,Kp为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示,温度升高时,Kp
],其中,Kp为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示,温度升高时,Kp____ (填“增大”或“减小”或“不变”),T>Tm时v逐渐减小的原因是_____ 。
I.CoO(s)+CO(g)
 Co(s)+CO2(g)
Co(s)+CO2(g)II.CoO(s)+H2(g)
 Co(s)+H2O(g)
Co(s)+H2O(g)同时存在副反应III.CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1回答下列问题:
(1)几种化学键的键能如表所示:
| 化学键 | C≡O | H-H | H-O | C=O |
| 键能/kJ·mol-1 | a | 436 | 463 | 750 |
则a=
(2)823K时,将0.1molH2和0.2molCO2充入1L密闭容器中,发生反应III,平衡后容器内总压强为50.66kPa,此时H2O(g)的体积分数为0.2,向容器中加入足量CoO(s)和Co(s),继续反应达平衡后容器中H2O(g)的体积分数为0.3。此时容器中H2的物质的量n(H2)=
(3)研究表明,CO2(g)+H2(g)
 CO(g)+H2O(g)反应速率方程为v=k[c(CO)•c(H2O)-
CO(g)+H2O(g)反应速率方程为v=k[c(CO)•c(H2O)-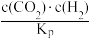 ],其中,Kp为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示,温度升高时,Kp
],其中,Kp为压强平衡常数,k为反应速率常数且随温度升高而增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示,温度升高时,Kp
您最近一年使用:0次
2022-08-30更新
|
217次组卷
|
4卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
名校
2 . 磷酸亚铁锂(LiFePO4)是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。

常温下各种硫化物溶度积常数如表:
回答下列问题:
(1)操作1、操作2的实验操作名称为____ 。
(2)加入Na2S溶液的目的是____ ,聚丙烯的作用是____ 。
(3)向滤液2中加入NaOH溶液需控制溶液的pH≤2.2,其原因为____ ;反应生成FePO4•2H2O的离子方程式为____ 。
(4)已知:Ksp(MgF2)=9×10-9、Ksp(CaF2)=1.5×10-10。若取1.0L废液,测得Ca2+浓度为0.02mol/L,Mg2+浓度为0.01mol/L,则至少需加入____ gNaF才能使废液中Mg2+沉淀完全(当离子浓度≤1×10-5mol·L-1,可认为沉淀完全)。
(5)锂离子电池在充电时,LiFePO4作____ (填“阳”或“阴”)极,脱出部分Li+,进而形成Li1-xFePO4。

常温下各种硫化物溶度积常数如表:
| 物质 | FeS | MnS | CuS | PbS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 1.6×10-24 |
回答下列问题:
(1)操作1、操作2的实验操作名称为
(2)加入Na2S溶液的目的是
(3)向滤液2中加入NaOH溶液需控制溶液的pH≤2.2,其原因为
(4)已知:Ksp(MgF2)=9×10-9、Ksp(CaF2)=1.5×10-10。若取1.0L废液,测得Ca2+浓度为0.02mol/L,Mg2+浓度为0.01mol/L,则至少需加入
(5)锂离子电池在充电时,LiFePO4作
您最近一年使用:0次
2022-08-26更新
|
161次组卷
|
3卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
名校
3 . 原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。
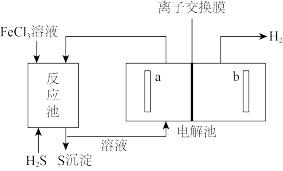
下列说法错误的是

下列说法错误的是
| A.电解池中电极a为阳极 |
| B.从反应池进入电解池的溶液溶质为FeCl2和HCl |
| C.H+通过离子交换膜到电解池右极室 |
| D.生成5.6LH2(标准状况),理论上在反应池中生成0.5molS沉淀 |
您最近一年使用:0次
2022-08-26更新
|
269次组卷
|
6卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
名校
解题方法
4 . 某小组探究Cu与HNO3反应,室温下,3mol·L-1的稀硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,向溶液中加入适量硝酸铜,无明显现象;浓硝酸遇铜片立即产生气泡,进一步操作如图:

已知:NO2易溶于水,可部分发生反应2NO2+H2O=HNO2+HNO3。下列说法正确的是

已知:NO2易溶于水,可部分发生反应2NO2+H2O=HNO2+HNO3。下列说法正确的是
A.铜与浓硝酸反应的离子方程式为3Cu+8H++2NO =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
| B.稀硝酸遇铜片产生气体为无色,该气体遇到空气不变色 |
| C.硝酸铜对稀硝酸与铜反应具有催化作用 |
| D.蓝色溶液B中的NO2或HNO2对稀硝酸与铜的反应起催化作用 |
您最近一年使用:0次
2022-08-26更新
|
372次组卷
|
7卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
名校
5 . 盐酸羟胺(NH2OH•HCl)用途广泛,可利用如图装置来制备。以盐酸为离子导体,向两电极分别通入NO和H2。下列说法正确的是
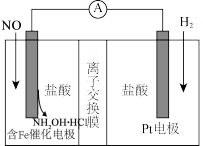

| A.Pt电极为原电池的正极 |
| B.Cl-通过离子交换膜到右极室 |
| C.一段时间后,含Fe的催化电极所在极室的pH增大 |
| D.每生成1mol盐酸羟胺电路中转移4mole- |
您最近一年使用:0次
2022-08-26更新
|
512次组卷
|
11卷引用:内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题
内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题河南省百所名校2023届高三上学期开学摸底联考化学试题广东省2023届高三8月开学摸底大联考化学试题河北省秦皇岛市部分学校2022-2023学年高三上学期开学考试化学试题山东省部分学校2023届高三上学期开学摸底联考(山东卷)化学试题山东师范大学附属中学2022-2023 学年高三上学期10月学情诊断考试化学试题山东师范大学附属中学2022-2023学年高三上学期第一次月考化学试题辽宁省2022-2023学年高三上学期开学摸底联考化学试题陕西省咸阳高新一中2023届高三上学期第一次质量检测化学试题山东省部分学校2023-2024学年高三上学期12月联考化学试卷陕西省名校协作体2023-2024学年高三上学期12月月考化学试题
名校
6 . 如图是实验室制溴苯的装置图,下列说法错误的是
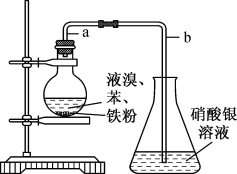

| A.因为液溴易挥发,所以可以用溴水代替液溴来完成此实验 |
| B.装置中b管不能伸入液面以下,防止倒吸 |
C.苯和液溴在烧瓶中发生反应的化学方程式为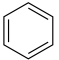 +Br2 +Br2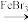 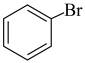 +HBr +HBr |
| D.要用此装置验证制溴苯是取代反应而不是加成反应,有学生认为此装置存在缺陷,应在圆底烧瓶和锥形瓶之间增加一个除溴装置 |
您最近一年使用:0次
7 . 绿色化学实验是指在绿色化学思想指导下,对常规实验进行改革而形成的实验新方法。下列符合绿色化学实验操作的是
| A.将氯酸钾和二氧化锰共热后的残余物回收分离 |
| B.将锌和稀硫酸反应后的废液倒入下水道中 |
| C.将跟氧气反应后剩余的硫磺放在空气中燃烧完全 |
| D.将一氧化碳还原氧化铜的尾气排入空气中 |
您最近一年使用:0次
2022-07-20更新
|
126次组卷
|
4卷引用:内蒙古自治区阿拉善盟第一中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
8 . 按要求回答下列问题:
(1)25℃时,0.1mol/L的下列溶液:①KCl溶液、② 溶液、③
溶液、③ 溶液,④
溶液,④ 溶液,水的电离程度由大到小顺序为
溶液,水的电离程度由大到小顺序为_______ (填标号),0.1mol/L的 溶液中水电离出的
溶液中水电离出的
_______ mol/L。
(2)已知 的电离是分步进行的,常温下
的电离是分步进行的,常温下 ,
, ,
, ,
, 溶液显
溶液显_______ 性(填“酸”、“碱”或“中”),该溶液中
_______ 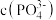 (填“>”或“<”)
(填“>”或“<”)
(3)25℃时,aL的盐酸和 的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若
的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若 ,则
,则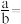
_______ (填数据)
(4)常温下, 溶液与
溶液与 溶液充分反应后,溶液
溶液充分反应后,溶液 ,则
,则 的电离常数
的电离常数
_______ (用含b的代数式表示)
(5)向含有 、
、 的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的 时,
时,
_______ [ ]
]
(1)25℃时,0.1mol/L的下列溶液:①KCl溶液、②
 溶液、③
溶液、③ 溶液,④
溶液,④ 溶液,水的电离程度由大到小顺序为
溶液,水的电离程度由大到小顺序为 溶液中水电离出的
溶液中水电离出的
(2)已知
 的电离是分步进行的,常温下
的电离是分步进行的,常温下 ,
, ,
, ,
, 溶液显
溶液显
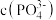 (填“>”或“<”)
(填“>”或“<”)(3)25℃时,aL的盐酸和
 的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若
的氢氧化钠溶液(x≤6,y≥8)混合后,二者恰好完全中和,若 ,则
,则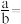
(4)常温下,
 溶液与
溶液与 溶液充分反应后,溶液
溶液充分反应后,溶液 ,则
,则 的电离常数
的电离常数
(5)向含有
 、
、 的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
的混合溶液中滴加NaOH溶液,当两种沉淀共存且溶液的 时,
时,
 ]
]
您最近一年使用:0次



