名校
1 . 下列各图均能表示某种分子的结构,按要求回答下列问题。__________ 模型,其电子式是________________ 。
(2)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________ ,空间构型为________ 。
(3)写出上述中A、E的分子式和结构简式:A.________ ;________________ ; E.________ ;_________________ ;
(4)B中共平面的原子最多有_______ 个,F中共一条直线的原子最多有_______ 个,
(5)互为同系物的是_______ 。互为同分异构体的是_______ 。(填序号)
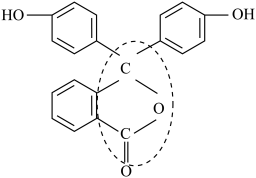
(6)酚酞是常用的酸碱指示剂,其结构简式如图所示:
A.  B.
B.  C.
C.  D.
D.  E.
E. 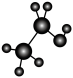 F.
F. 
(2)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为
(3)写出上述中A、E的分子式和结构简式:A.
(4)B中共平面的原子最多有
(5)互为同系物的是
(6)酚酞是常用的酸碱指示剂,其结构简式如图所示:
| A.烯烃 | B.芳香化合物 | C.醚类物质 | D.酯类物质 |
您最近一年使用:0次
2 . 现有如图所示的转化关系,已知:A为高级脂肪酸甘油酯。回答下列问题:___________ ,D的结构简式为___________ 。
(2)①的化学方程式为________________ ;③的反应类型为________ 反应。
(3)完全燃烧等物质的量的B和某烷烃消耗等量的氧气,则该烷烃的名称为___________ 。
(4)m g某天然油脂完全水解需要18gNaOH,则m g该油脂的物质的量为___________ mol。
(5)一定量的CH3COOH和O2混合后完全反应生成CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重10.8g,碱石灰增重13.2g。则n(CH3COOH)︰n(O2)=___________ 。

(2)①的化学方程式为
(3)完全燃烧等物质的量的B和某烷烃消耗等量的氧气,则该烷烃的名称为
(4)m g某天然油脂完全水解需要18gNaOH,则m g该油脂的物质的量为
(5)一定量的CH3COOH和O2混合后完全反应生成CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重10.8g,碱石灰增重13.2g。则n(CH3COOH)︰n(O2)=
您最近一年使用:0次
名校
解题方法
3 . 现有下列8种物质:① ②小苏打 ③
②小苏打 ③ 溶液 ④
溶液 ④ ⑤酒精 ⑥
⑤酒精 ⑥ ⑦氢氧化铁胶体 ⑧空气
⑦氢氧化铁胶体 ⑧空气
(1) 属于分散系的是___________ (填物质序号),小苏打在水中的电离方程式为___________ 。工业制漂白粉的方程式是___________ 。
(2)若氢氧化铁胶体中混有少量的 溶液,提纯的方法是___________。
溶液,提纯的方法是___________。
(3) ⑤酒精分子中含氢原子的物质的量为
⑤酒精分子中含氢原子的物质的量为___________ ,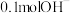 所含电子为
所含电子为___________ 个。
(4)同质量的 和
和 气体在相同条件下的体积比为
气体在相同条件下的体积比为___________ ,其中含有的氢原子数目比为___________ ,由 和
和 组成的混合气体20克,标准状态下体积
组成的混合气体20克,标准状态下体积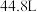 ,则氨气与氢气的物质的量为
,则氨气与氢气的物质的量为___________ 。
 ②小苏打 ③
②小苏打 ③ 溶液 ④
溶液 ④ ⑤酒精 ⑥
⑤酒精 ⑥ ⑦氢氧化铁胶体 ⑧空气
⑦氢氧化铁胶体 ⑧空气(1) 属于分散系的是
(2)若氢氧化铁胶体中混有少量的
 溶液,提纯的方法是___________。
溶液,提纯的方法是___________。| A.蒸馏(分馏) | B.过滤 | C.渗析 | D.蒸发 |
 ⑤酒精分子中含氢原子的物质的量为
⑤酒精分子中含氢原子的物质的量为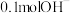 所含电子为
所含电子为(4)同质量的
 和
和 气体在相同条件下的体积比为
气体在相同条件下的体积比为 和
和 组成的混合气体20克,标准状态下体积
组成的混合气体20克,标准状态下体积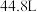 ,则氨气与氢气的物质的量为
,则氨气与氢气的物质的量为
您最近一年使用:0次
解题方法
4 . Ⅰ. 全钒液流电池 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为 放电工作原理。
放电工作原理。
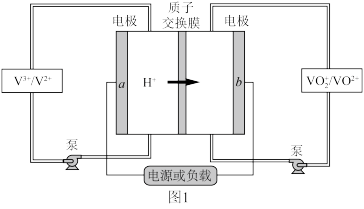
(1)电极 为
为___________ 极(填“正”或“负”),充电时, 电极的反应为
电极的反应为___________ 。
(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
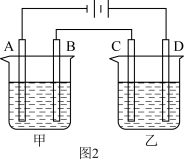
①甲槽是电极电解饱和食盐水的装置,产生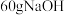 时,
时,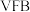 电池中消耗
电池中消耗___________ 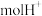 。
。
②乙槽为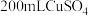 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为___________  。
。
③若通电一段时间后,向所得的乙槽溶液中加入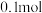 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为___________ (用 表示)。
表示)。
Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有 ,其中
,其中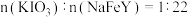 (其中
(其中 显
显 价);
价);
② 。
。
实验步骤:称取 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用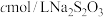 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。
(3)滴定终点的现象为___________ 。
(4)样品中铁元素的质量分数为___________ 。
 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为 放电工作原理。
放电工作原理。
(1)电极
 为
为 电极的反应为
电极的反应为(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生
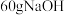 时,
时,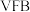 电池中消耗
电池中消耗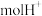 。
。②乙槽为
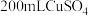 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为 。
。③若通电一段时间后,向所得的乙槽溶液中加入
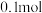 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为 表示)。
表示)。Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有
 ,其中
,其中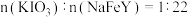 (其中
(其中 显
显 价);
价);②
 。
。实验步骤:称取
 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用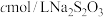 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。(3)滴定终点的现象为
(4)样品中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 赤铁矿的主要成分为Fe2O3,为测定赤铁矿矿样中铁的百分含量,有如下两种预处理方法:
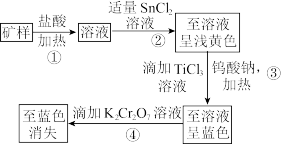
已知:①Sn、Hg、Ti在溶液中存在的形式有Sn2+、Sn4+、Hg2+、H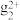 、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
②钨酸钠(Na2WO4)可作指示剂,若W(Ⅵ)还原为W(Ⅴ),溶液将呈现蓝色。氧化性:Fe3+>W 。
。
(1)矿样与盐酸反应的主要化学方程式为___________ 。
(2)过程①发生反应的离子方程式为___________ ,过程②产生的沉淀是___________ (填化学式)。
(3)Na2WO4中W的化合价为___________ ,加入指示剂钨酸钠(Na2WO4)的作用是___________ 。
(4)现称取0.2 g矿样进行上述预处理后,加入H2SO4-H3PO4混酸溶液,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,消耗0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL。
①配平滴定时发生反应的离子方程式: Fe2++
Fe2++ Cr2
Cr2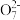 +
+ H+=
H+= Fe3++
Fe3++ Cr3++
Cr3++ H2O
H2O___________ 。
②原矿样中铁的百分含量为___________ ,若矿样预处理后溶液放置过久,对测定结果的影响是___________ (填“偏高”、“偏低”或“无影响”)。

已知:①Sn、Hg、Ti在溶液中存在的形式有Sn2+、Sn4+、Hg2+、H
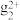 、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。②钨酸钠(Na2WO4)可作指示剂,若W(Ⅵ)还原为W(Ⅴ),溶液将呈现蓝色。氧化性:Fe3+>W
 。
。(1)矿样与盐酸反应的主要化学方程式为
(2)过程①发生反应的离子方程式为
(3)Na2WO4中W的化合价为
(4)现称取0.2 g矿样进行上述预处理后,加入H2SO4-H3PO4混酸溶液,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,消耗0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL。
①配平滴定时发生反应的离子方程式:
 Fe2++
Fe2++ Cr2
Cr2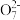 +
+ H+=
H+= Fe3++
Fe3++ Cr3++
Cr3++ H2O
H2O②原矿样中铁的百分含量为
您最近一年使用:0次
名校
解题方法
6 . 许多无机颜料在多彩的世界中扮演了重要角色。如历史悠久的铅白[2PbCO3·Pb(OH)2]、安全环保的钛白(TiO2)、鲜艳的朱砂(HgS)、稳定的金粉(Au)等。上述颜料未涉及的物质类别是
| A.氧化物 | B.单质 | C.碱 | D.盐 |
您最近一年使用:0次
解题方法
7 . 请完成以下离子方程式的书写。
(1)二氧化锰与浓盐酸共热制氯气__________ 。
(2)鸡蛋壳溶于醋酸中_________ 。
(3)NaHSO4溶液与Ba(OH)2溶液反应后呈中性_________ 。
(4)弱酸环境下,高锰酸钾将Mn2+氧化为MnO2_________ 。
(1)二氧化锰与浓盐酸共热制氯气
(2)鸡蛋壳溶于醋酸中
(3)NaHSO4溶液与Ba(OH)2溶液反应后呈中性
(4)弱酸环境下,高锰酸钾将Mn2+氧化为MnO2
您最近一年使用:0次
解题方法
8 . I.x、y、z三种气体的相对分子质量的关系为M(x)<M(y)=0.5M(z),则
(1)同温同压下,三种气体中密度最小的是__________ 。
(2)分子数目和等的三种气体,质量最大的是__________ 。
(3)20℃时,若2moly与1molz的体积相等,则y与z气体的压强比为__________ 。
II.丹砂炼汞的反应原理包括以下两个反应:
反应I:HgS+O2=Hg+SO2
反应II:HgS+CaO→Hg+CaS+CaSO4(未配平)
(4)反应I中,还原产物是__________ ,反应中每生成1molSO2,转移的电子数为__________ 。
(5)配平反应II,并用双线桥法标出反应中电子转移的方向和数目__________ 。
(1)同温同压下,三种气体中密度最小的是
(2)分子数目和等的三种气体,质量最大的是
(3)20℃时,若2moly与1molz的体积相等,则y与z气体的压强比为
II.丹砂炼汞的反应原理包括以下两个反应:
反应I:HgS+O2=Hg+SO2
反应II:HgS+CaO→Hg+CaS+CaSO4(未配平)
(4)反应I中,还原产物是
(5)配平反应II,并用双线桥法标出反应中电子转移的方向和数目
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)某温度时,测得 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数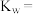
_____ ,该温度(填“>”“<”或“=”)_____ 25℃。
(2)明矾净水的原理是:_____ (用离子方程式表示)。
(3)滴定实验中,酸性高锰酸钾标准液装在_____ (填“酸式”或“碱式”)滴定管中。
(4)常温下,将pH=2的醋酸和盐酸各1mL分别稀释至100mL,稀释后pH:醋酸_____ 盐酸(填“>”“<”或“=”)。稀释后溶液中水的电离程度:醋酸_____ 盐酸(填“>”“<”或“=”)。
(5)常温下,等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系为_____ 。
(6)常温下,向10mL浓度均为 的HCl和CH3COOH的混合溶液中加入等体积
的HCl和CH3COOH的混合溶液中加入等体积 的NaOH溶液,充分反应后混合溶液呈
的NaOH溶液,充分反应后混合溶液呈_____ (填“酸性”“碱性”或“中性”),混合溶液中离子浓度由大到小的顺序为_____ 。
(7)常温下,用pH=4和pH=11的强酸和强碱混合,使pH=10,则酸、碱溶液的体积比为_____ 。
(1)某温度时,测得
 的NaOH溶液的pH为11,则该温度下水的离子积常数
的NaOH溶液的pH为11,则该温度下水的离子积常数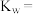
(2)明矾净水的原理是:
(3)滴定实验中,酸性高锰酸钾标准液装在
(4)常温下,将pH=2的醋酸和盐酸各1mL分别稀释至100mL,稀释后pH:醋酸
(5)常温下,等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系为
(6)常温下,向10mL浓度均为
 的HCl和CH3COOH的混合溶液中加入等体积
的HCl和CH3COOH的混合溶液中加入等体积 的NaOH溶液,充分反应后混合溶液呈
的NaOH溶液,充分反应后混合溶液呈(7)常温下,用pH=4和pH=11的强酸和强碱混合,使pH=10,则酸、碱溶液的体积比为
您最近一年使用:0次
10 . I.在恒温、恒容容器中进行反应CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)  。
。
(1)下列不能说明反应达到平衡状态的是_______ (填字母)。
A.CO2和H2的转化率之比不再变化
B.混合气体的平均摩尔质量不再变化
C.
D.容器内的气体压强不再变化
E.混合气体的平均密度不再变化
Ⅱ.一定条件下,CO2和H2可发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ;恒温条件下向4L的恒容容器中充入一定量的CO2和H2,发生上述反应。测得平衡时混合物中CH3OH(g)体积分数
;恒温条件下向4L的恒容容器中充入一定量的CO2和H2,发生上述反应。测得平衡时混合物中CH3OH(g)体积分数 与起始投料比Z[Z=
与起始投料比Z[Z= ]的关系如图1所示。
]的关系如图1所示。
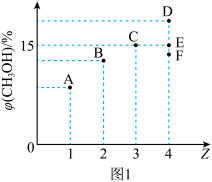
(2)当Z=3时,反应达到平衡时混合气体总压强与起始时容器内气体总压强之比的比值为_______ (结果保留2位小数)。
(3)当Z=4时,反应达到平衡状态后,CH3OH的体积分数可能是图1中的_______ 点(选填“D”“B”或“F”)。
(4)若充入1molCO2和2.8molH2,图2中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率 随时间
随时间 的变化曲线。
的变化曲线。
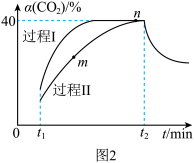
①m点 (逆)
(逆)_______  (正)(填“>”“<”或“=”)。
(正)(填“>”“<”或“=”)。
②n点时该反应的平衡常数K=_______ (结果保留3位有效数字!)。
③过程Ⅱ反应的活化能_______ 过程I反应的活化能(填“大于”“小于”或“等于”)。
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)  。
。(1)下列不能说明反应达到平衡状态的是
A.CO2和H2的转化率之比不再变化
B.混合气体的平均摩尔质量不再变化
C.

D.容器内的气体压强不再变化
E.混合气体的平均密度不再变化
Ⅱ.一定条件下,CO2和H2可发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ;恒温条件下向4L的恒容容器中充入一定量的CO2和H2,发生上述反应。测得平衡时混合物中CH3OH(g)体积分数
;恒温条件下向4L的恒容容器中充入一定量的CO2和H2,发生上述反应。测得平衡时混合物中CH3OH(g)体积分数 与起始投料比Z[Z=
与起始投料比Z[Z= ]的关系如图1所示。
]的关系如图1所示。
(2)当Z=3时,反应达到平衡时混合气体总压强与起始时容器内气体总压强之比的比值为
(3)当Z=4时,反应达到平衡状态后,CH3OH的体积分数可能是图1中的
(4)若充入1molCO2和2.8molH2,图2中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率
 随时间
随时间 的变化曲线。
的变化曲线。
①m点
 (逆)
(逆) (正)(填“>”“<”或“=”)。
(正)(填“>”“<”或“=”)。②n点时该反应的平衡常数K=
③过程Ⅱ反应的活化能
您最近一年使用:0次
2023-09-01更新
|
222次组卷
|
2卷引用:江西省南昌县莲塘第一中学2022-2023学年高二上学期11月期中化学试题



