解题方法
1 . 维生素C又称抗坏血酸,是一种水溶性的维生素,水溶液呈酸性,其化学式为 。维生素C的主要作用是提高人体免疫力,预防癌症、心脏病、中风,保护牙齿和牙龈等。某校课外活动小组测定了某新鲜水果中维生素C的含量,测定实验分析报告如下,请回答下列问题:
。维生素C的主要作用是提高人体免疫力,预防癌症、心脏病、中风,保护牙齿和牙龈等。某校课外活动小组测定了某新鲜水果中维生素C的含量,测定实验分析报告如下,请回答下列问题:
I.测定目的:测定某新鲜水果中维生素C的含量
II.测定原理: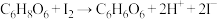 (假定其他物质与
(假定其他物质与 不反应)
不反应)
Ⅲ.实验用品及试剂
仪器和用品(自选,略)
(1)试剂:浓度为 的
的 标准溶液、
标准溶液、_______ (填指示剂名称)、蒸馏水等。
Ⅳ.实验过程
(2)制备新鲜水果组织提取液:称取50 g新鲜水果,放入多功能食物粉碎机中,加入50 mL蒸馏水,然后进行粉碎、过滤,将滤液转移至100 mL容量瓶中,定容,用_______ (填“酸式”或“碱式”)滴定管向锥形瓶中移入20.00 mL待测液,加入2 mL指示剂,然后滴加盐酸,将溶液pH调至3。
(3)_______ ,洗涤仪器,润洗后装好 标准溶液待用。
标准溶液待用。
(4)用左手控制滴定管的_______ (填部位),右手摇动锥形瓶,眼睛注视_______ ,直到滴定终点。滴定至终点时的现象是_______ 。
重复实验2~3次。
V.数据记录与处理
(5) (请设计一个数据记录和数据处理的表格,不需要填数据)_______
(6)若经数据处理后,滴定中平均消耗 标准溶液的体积是15.00 mL,则此新鲜水果中维生素C的含量是
标准溶液的体积是15.00 mL,则此新鲜水果中维生素C的含量是_______  。
。
VI.问题讨论
(7)滴定结束后,若俯视滴定管读数,则测定结果会_______ (填“偏低”、“偏高”或“无影响”)。
 。维生素C的主要作用是提高人体免疫力,预防癌症、心脏病、中风,保护牙齿和牙龈等。某校课外活动小组测定了某新鲜水果中维生素C的含量,测定实验分析报告如下,请回答下列问题:
。维生素C的主要作用是提高人体免疫力,预防癌症、心脏病、中风,保护牙齿和牙龈等。某校课外活动小组测定了某新鲜水果中维生素C的含量,测定实验分析报告如下,请回答下列问题:I.测定目的:测定某新鲜水果中维生素C的含量
II.测定原理:
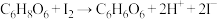 (假定其他物质与
(假定其他物质与 不反应)
不反应)Ⅲ.实验用品及试剂
仪器和用品(自选,略)
(1)试剂:浓度为
 的
的 标准溶液、
标准溶液、Ⅳ.实验过程
(2)制备新鲜水果组织提取液:称取50 g新鲜水果,放入多功能食物粉碎机中,加入50 mL蒸馏水,然后进行粉碎、过滤,将滤液转移至100 mL容量瓶中,定容,用
(3)
 标准溶液待用。
标准溶液待用。(4)用左手控制滴定管的
重复实验2~3次。
V.数据记录与处理
(5) (请设计一个数据记录和数据处理的表格,不需要填数据)
(6)若经数据处理后,滴定中平均消耗
 标准溶液的体积是15.00 mL,则此新鲜水果中维生素C的含量是
标准溶液的体积是15.00 mL,则此新鲜水果中维生素C的含量是 。
。VI.问题讨论
(7)滴定结束后,若俯视滴定管读数,则测定结果会
您最近一年使用:0次
2 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸溶液是常用的消毒剂,可利用Cl2O与水反应得到。根据该原理,某化学兴趣小组利用如下装置制备一定浓度的次氯酸溶液。已知:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解为Cl2和O2。实验时,将氯气和空气(不参与反应)按体积比为1:3混合通入含水8%的碳酸钠糊状物中,请回答下列问题:
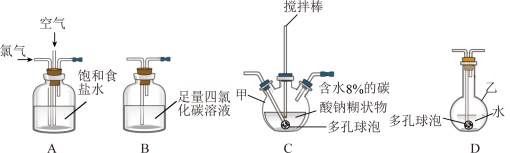
(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为_______ 。
(2)装置C中的仪器甲的名称为_______ ,仪器甲中发生反应的化学方程式为_______ ,为了提高 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为_______ 。
(3)装置 的作用为
的作用为_______ ,有同学建议将装置 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是_______ 。
(4)测定装置D中得到的次氯酸的物质的量浓度。量取 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。
①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为_______ 。
②达到滴定终点的现象为_______ 。
③装置D中得到的次氯酸的物质的量浓度为_______ mol/L。
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将_______ (填“偏低”、“偏高”或“无影响”)。

(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为
(2)装置C中的仪器甲的名称为
 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为(3)装置
 的作用为
的作用为 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是(4)测定装置D中得到的次氯酸的物质的量浓度。量取
 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为
②达到滴定终点的现象为
③装置D中得到的次氯酸的物质的量浓度为
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将
您最近一年使用:0次
3 . 臭氧 是人类的好朋友。生活中常用臭氧杀菌消毒,大气层中臭氧层是人类“保护伞”。
是人类的好朋友。生活中常用臭氧杀菌消毒,大气层中臭氧层是人类“保护伞”。
(1)常用臭氧来治理电镀工业中含氰废水,不会引起二次污染。
① (平衡常数)
(平衡常数)
② (平衡常数)
(平衡常数)
 (平衡常数)。
(平衡常数)。

_______ (用含 的式子表示);
的式子表示);
_______ (用含 的式子表示)。
的式子表示)。
(2)常温下,在刚性密闭容器中充入足量的 ,和
,和 发生反应:
发生反应:
 ,下列图像正确且表明
,下列图像正确且表明 时达到化学平衡状态的是_______(填字母)。
时达到化学平衡状态的是_______(填字母)。
(3)臭氧 能使颜色变暗的油画复原,发生反应为
能使颜色变暗的油画复原,发生反应为 。在恒容密闭容器中充入足量
。在恒容密闭容器中充入足量 和
和 ,发生上述反应。达到平衡后,再充入少量
,发生上述反应。达到平衡后,再充入少量 ,
, 的平衡转化率
的平衡转化率_______ (填“增大”“减小”或“不变”)。
(4)已知: 。在温度
。在温度 下,向总压强恒定为
下,向总压强恒定为 的密闭容器中充入适量的
的密闭容器中充入适量的 和惰性气体
和惰性气体 (不参与反应)的混合气体,
(不参与反应)的混合气体, 的平衡转化率与通入气体中惰性气体
的平衡转化率与通入气体中惰性气体 与
与 的体积之比
的体积之比 关系如图所示。
关系如图所示。

①在相同温度下,随着x增大, 的平衡转化率增大的原因是
的平衡转化率增大的原因是_______ 。
②温度
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③已知:在 温度下,按
温度下,按 与
与 体积比为2.0投料,反应开始经过
体积比为2.0投料,反应开始经过 时恰好达到M点,则这段时间内
时恰好达到M点,则这段时间内 分压的变化率为
分压的变化率为_______ 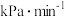 。
。 温度下,该反应的平衡常数
温度下,该反应的平衡常数
_______  (结果保留一位小数)。提示:用分压计算的平衡常数为
(结果保留一位小数)。提示:用分压计算的平衡常数为 ,分压等于总压×物质的量分数。
,分压等于总压×物质的量分数。
 是人类的好朋友。生活中常用臭氧杀菌消毒,大气层中臭氧层是人类“保护伞”。
是人类的好朋友。生活中常用臭氧杀菌消毒,大气层中臭氧层是人类“保护伞”。(1)常用臭氧来治理电镀工业中含氰废水,不会引起二次污染。
①
 (平衡常数)
(平衡常数)②
 (平衡常数)
(平衡常数) (平衡常数)。
(平衡常数)。
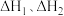 的式子表示);
的式子表示);
 的式子表示)。
的式子表示)。(2)常温下,在刚性密闭容器中充入足量的
 ,和
,和 发生反应:
发生反应:
 ,下列图像正确且表明
,下列图像正确且表明 时达到化学平衡状态的是_______(填字母)。
时达到化学平衡状态的是_______(填字母)。A. | B. | C. | D. |
 能使颜色变暗的油画复原,发生反应为
能使颜色变暗的油画复原,发生反应为 。在恒容密闭容器中充入足量
。在恒容密闭容器中充入足量 和
和 ,发生上述反应。达到平衡后,再充入少量
,发生上述反应。达到平衡后,再充入少量 ,
, 的平衡转化率
的平衡转化率(4)已知:
 。在温度
。在温度 下,向总压强恒定为
下,向总压强恒定为 的密闭容器中充入适量的
的密闭容器中充入适量的 和惰性气体
和惰性气体 (不参与反应)的混合气体,
(不参与反应)的混合气体, 的平衡转化率与通入气体中惰性气体
的平衡转化率与通入气体中惰性气体 与
与 的体积之比
的体积之比 关系如图所示。
关系如图所示。
①在相同温度下,随着x增大,
 的平衡转化率增大的原因是
的平衡转化率增大的原因是②温度

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③已知:在
 温度下,按
温度下,按 与
与 体积比为2.0投料,反应开始经过
体积比为2.0投料,反应开始经过 时恰好达到M点,则这段时间内
时恰好达到M点,则这段时间内 分压的变化率为
分压的变化率为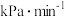 。
。 温度下,该反应的平衡常数
温度下,该反应的平衡常数
 (结果保留一位小数)。提示:用分压计算的平衡常数为
(结果保留一位小数)。提示:用分压计算的平衡常数为 ,分压等于总压×物质的量分数。
,分压等于总压×物质的量分数。
您最近一年使用:0次
2022-11-12更新
|
183次组卷
|
3卷引用:江西省新余市第一中学2022-2023学年高二上学期期中考试化学试题
解题方法
4 . 下列反应为工业上用 制备
制备 的体系中发生的反应:
的体系中发生的反应:
反应①:
 kJ·mol
kJ·mol
反应②:
 kJ·mol
kJ·mol
反应③:
 kJ·mol
kJ·mol
相关反应的平衡常数K与温度的关系如图所示:
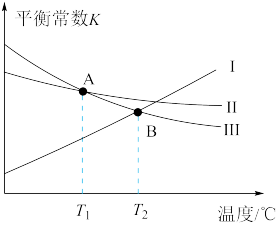
回答下列问题:
(1)曲线Ⅰ对应的是反应_________ (填标号,下同),该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。
(2)水煤气法制 的反应为
的反应为
 ,则:
,则:
①
_________ 。
②该反应在M催化剂上的反应历程为:
第一步:
 ,快反应。
,快反应。
第二步:
 ,慢反应。
,慢反应。
下列图像与该反应历程相符的是_________ (填标号)。
A.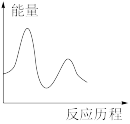 B.
B.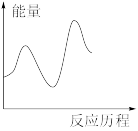 C.
C.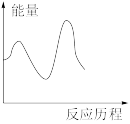 D.
D.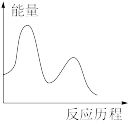
③ ℃时,向2 L恒容密闭容器中充入1 mol
℃时,向2 L恒容密闭容器中充入1 mol  和1 mol
和1 mol  ,5 min后,反应达到平衡,则0~5 min内,
,5 min后,反应达到平衡,则0~5 min内,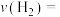
_________ ;该温度下该反应的平衡常数
_________ 。
(3) ℃时,向某恒容密闭容器中加入1 mol
℃时,向某恒容密闭容器中加入1 mol  和1 mol
和1 mol  ,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下
,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下 转化为
转化为 的选择性[
的选择性[ 的选择性
的选择性 为20%,则
为20%,则 的转化率为
的转化率为_________ ;平衡时,CO的分压为_________ (用含p的代数式表示)。
 制备
制备 的体系中发生的反应:
的体系中发生的反应:反应①:

 kJ·mol
kJ·mol
反应②:

 kJ·mol
kJ·mol
反应③:

 kJ·mol
kJ·mol
相关反应的平衡常数K与温度的关系如图所示:

回答下列问题:
(1)曲线Ⅰ对应的是反应
(2)水煤气法制
 的反应为
的反应为
 ,则:
,则:①

②该反应在M催化剂上的反应历程为:
第一步:

 ,快反应。
,快反应。第二步:

 ,慢反应。
,慢反应。下列图像与该反应历程相符的是
A.
 B.
B. C.
C. D.
D.
③
 ℃时,向2 L恒容密闭容器中充入1 mol
℃时,向2 L恒容密闭容器中充入1 mol  和1 mol
和1 mol  ,5 min后,反应达到平衡,则0~5 min内,
,5 min后,反应达到平衡,则0~5 min内,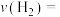

(3)
 ℃时,向某恒容密闭容器中加入1 mol
℃时,向某恒容密闭容器中加入1 mol  和1 mol
和1 mol  ,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下
,同时发生反应①和③,测得起始压强为p,达到平衡后,测得压强为起始压强的1.4倍,已知该条件下 转化为
转化为 的选择性[
的选择性[ 的选择性
的选择性 为20%,则
为20%,则 的转化率为
的转化率为
您最近一年使用:0次
2022-11-11更新
|
133次组卷
|
3卷引用:江西省名校联盟2022-2023学年高二上学期期中联考化学试题
解题方法
5 . 元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系;运用元素周期律研究元素及其化合物的性质具有重要的意义。

上图为元素周期表的一部分,根据表中给出的9种元素,回答下列问题:
(1)元素⑦在周期表中的位置为第_______ 周期第_______ 族,其氧化物属于_______ (填“酸性”“碱性”或“两性”)氧化物。
(2)周期表所给九种元素中原子半径最大的元素是_______ (填元素名称);最高价含氧酸酸性最强的是_______ (填化学式)。
(3)写出元素⑥的单质与元素④的最高价氧化物对应水化物反应的离子方程式:_______ 。
(4)元素③⑦⑧形成简单氢化物的稳定性:_______ >_______ >_______ (填化学式)。
(5)由元素①④⑧形成的化合物属于_______ (填“离子”或“共价”)化合物,该化合物中含有的化学键类型有_______ 。
(6)下列不能说明⑤⑥两种元素金属性相对强弱的是_______(填字母)。

上图为元素周期表的一部分,根据表中给出的9种元素,回答下列问题:
(1)元素⑦在周期表中的位置为第
(2)周期表所给九种元素中原子半径最大的元素是
(3)写出元素⑥的单质与元素④的最高价氧化物对应水化物反应的离子方程式:
(4)元素③⑦⑧形成简单氢化物的稳定性:
(5)由元素①④⑧形成的化合物属于
(6)下列不能说明⑤⑥两种元素金属性相对强弱的是_______(填字母)。
| A.⑤的氧化物是碱性氧化物,⑥的氧化物是两性氧化物 |
| B.最高价氧化物对应水化物碱性:⑤>⑥ |
| C.与同浓度的盐酸反应,⑤的单质比⑥剧烈 |
D.⑤和⑥均可以从 溶液中置换出铜单质 溶液中置换出铜单质 |
您最近一年使用:0次
名校
解题方法
6 . 近日“宁德时代”宣布2023年实现钠离子电池产业化,钠离子电池以其低成本、高安全性及其优异电化学属性等成为锂离子电池的首选“备胎”,其充放电过程是 在正负极间的镶嵌与脱嵌。下列说法
在正负极间的镶嵌与脱嵌。下列说法不正确 的是
 在正负极间的镶嵌与脱嵌。下列说法
在正负极间的镶嵌与脱嵌。下列说法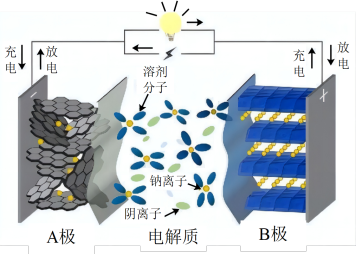
| A.放电时负极区钠单质失去电子 |
B.充电时 由“B极”向“A极”移动 由“B极”向“A极”移动 |
| C.由于未使用稀缺的锂钴元素,量产后该电池生产成本比锂离子电池低 |
D.该电池一种正极材料为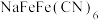 ,充电时的电极反应为: ,充电时的电极反应为: |
您最近一年使用:0次
2022-08-08更新
|
2753次组卷
|
12卷引用:江西省南昌市第十九中学2022-2023学年高三上学期(10月)第三次月考化学试卷
江西省南昌市第十九中学2022-2023学年高三上学期(10月)第三次月考化学试卷广东省六校2023届高三第一次联考化学试题广东省广州市六校2023届高三上学期8月第一次联考化学试题福建省三明第一中学2022-2023学年高三上学期第二次月考化学试题(已下线)热点情景汇编-专题八 化学反应中的电能(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题广东省深圳市新安中学2022-2023学年高三上学期周末测试(2022.9.25)化学试题(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)T12-电化学原理(已下线)T10-电化学原理2024届安徽省六安第一中学高三下学期质量检测(三 )化学试题
解题方法
7 . 随着社会不断发展,资源越来越紧缺,对金属回收再利用显得非常重要,近年来,新能源汽车行业的不断发展,产生了大量的废旧三元锂电池,其正极材料主要含锂、镍、钴、锰等元素,科学家最新研究一种高温还原和湿法冶金联用方法回收报废三元电池正极材料中的镍、钴、锰以及金属锂。其工艺如下:
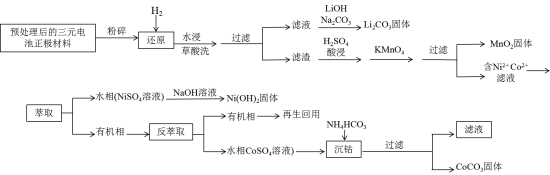
回答下列问题
(1)将正极材料粉碎的目的是_______ 。
(2)写出H2SO4酸浸后溶液中的Mn2+转化为MnO2的离子方程式_______ 。
(3)一定温度下,硫酸浓度对金属浸出率的影响如图所示,则酸浸时,最佳的硫酸浓度是_______ 。

(4)实验室萃取操作使用的主要玻璃仪器的名称____ ,将上层液体分离出来的操作_____ 。
(5)写出沉钴的离子方程式_______ ,在整个回收工艺中,可回收到的金属化合物有_____ 。
(6)向0.5mol/LNiSO4溶液中加NaOH溶液,当Ni2+沉淀完全时溶液pH不低于_______ 。(已知Ksp[Ni(OH)2]=1×10-15)

回答下列问题
(1)将正极材料粉碎的目的是
(2)写出H2SO4酸浸后溶液中的Mn2+转化为MnO2的离子方程式
(3)一定温度下,硫酸浓度对金属浸出率的影响如图所示,则酸浸时,最佳的硫酸浓度是

(4)实验室萃取操作使用的主要玻璃仪器的名称
(5)写出沉钴的离子方程式
(6)向0.5mol/LNiSO4溶液中加NaOH溶液,当Ni2+沉淀完全时溶液pH不低于
您最近一年使用:0次
解题方法
8 . 长期以来,人们认为氮分子不能作配体形成配合物,直到1965年,化学家Allen偶然制备出了第一个分子氮配合物,震惊了化学界。从此以后,人们对分子氮配合物进行了大量的研究。利用下图装置以X: FeHCIL2(L为一种有机分子)和Z:Na[B(C6H5)4]为原料,在常温下直接与氮气反应可以制备分子氮配合物Y: [FeH(N2)L2][B(C6H5)4|。

相关物质的性质
(1)组装好仪器,检查装置气密性,通入氮气一段时间。其目的是_______ 。
(2)向A中加入含X1.5g的120mL的丙酮溶液,B中加入含Z1.5g的50mL的丙酮溶液。仪器A的容积应为_______ mL(填 250或500)。仪器B的名称为_______ 。
(3)继续通入氮气,慢慢将B中液体滴入到A中,打开磁力搅拌器搅拌30分钟,停止通气,冰水浴冷却,析出大量橙色晶体,快速过滤,洗涤,干燥得到粗产品。写出生成产品的化学方程式_______ 。
(4)将粗产品溶于丙酮,过滤;将滤液真空蒸发得橙色固体,用_______ 洗涤橙色固体,干燥、称量得到产品1.5g。计算本实验的产率_______ (用百分数表示, 保留1位小数)。
(5)人们之所以对分子氮配合物感兴趣,是因为某些分子氮配合物可以在常温常压下被还原为NH3。简述该过程的意义_______ 。

相关物质的性质
| 物质 | 相对分子质量 | 性质 |
| X:FeHCIL2 | 504.5 | 白色固体,易氧化,易溶于有机溶剂 |
| Y:[FeH(N2)L2][B(C6H5)4] | 816 | 橙色晶体,溶液中易氧化,固体较稳定,可溶于丙酮,难溶于于石油醚。 |
| Z:Na[B(C6H5)4] | 342 | 白色固体,易水解,易溶于丙酮,难溶于石油醚 |
(2)向A中加入含X1.5g的120mL的丙酮溶液,B中加入含Z1.5g的50mL的丙酮溶液。仪器A的容积应为
(3)继续通入氮气,慢慢将B中液体滴入到A中,打开磁力搅拌器搅拌30分钟,停止通气,冰水浴冷却,析出大量橙色晶体,快速过滤,洗涤,干燥得到粗产品。写出生成产品的化学方程式
(4)将粗产品溶于丙酮,过滤;将滤液真空蒸发得橙色固体,用
(5)人们之所以对分子氮配合物感兴趣,是因为某些分子氮配合物可以在常温常压下被还原为NH3。简述该过程的意义
您最近一年使用:0次
2022高三·全国·专题练习
9 . 高技术领域常使用高纯试剂。纯磷酸(熔点为 ,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成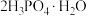 (熔点为
(熔点为 ),高于
),高于 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):

回答下列问题:
(1)A的名称是___________ 。B的进水口为___________ (填“a”或“b”)。
(2) 的作用是
的作用是___________ 。
(3)空气流入毛细管的主要作用是防止___________ ,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是___________ 。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入___________ 促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为___________ (填标号)。
A. B.
B. C.
C.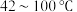
(7)磷酸中少量的水极难除去的原因是___________ 。
 ,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成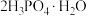 (熔点为
(熔点为 ),高于
),高于 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)A的名称是
(2)
 的作用是
的作用是(3)空气流入毛细管的主要作用是防止
(4)升高温度能提高除水速度,实验选用水浴加热的目的是
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为
A.
 B.
B. C.
C.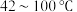
(7)磷酸中少量的水极难除去的原因是
您最近一年使用:0次
2022-07-12更新
|
9484次组卷
|
25卷引用:江西省南昌市三校(一中、十中、铁一中)2022-2023学年高三上学期11月期中联考化学试题
江西省南昌市三校(一中、十中、铁一中)2022-2023学年高三上学期11月期中联考化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)2022年海南省高考真题变式题15-19(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题16 化学实验综合题-备战2023年高考化学母题题源解密(广东卷)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题讲座(九) 化学实验中规范答题(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十三 实验探究中的新思路江西省宜春市丰城第九中学重点班2022-2023学年高二下学期开学质量检测化学试题(已下线)第一部分 二轮专题突破 大题突破2 综合实验题题型研究(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)云南省开远市第一中学校2022-2023学年高二下学期5月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第3讲 物质制备实验的设计与评价湖南省衡阳市衡阳县第一中学2024届高三上学期11月月考化学试题(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建
解题方法
10 . 我国制定了2030年“碳达峰”和2060年“碳中和”的目标,该目标任务非常艰巨,因此研究碳和碳氧化物(CO、CO2)的转化有着重要意义。
I.工业上CO2经催化加氢可以生成多种低碳有机物:
①

②

③

回答下列问题:
(1)反应③的 为
为_______ 。
(2)在绝热恒容的密闭容器中,将CO2和 按物质的量之比1:3投料发生反应①,下列不能说明反应已达到平衡的是_______(填字母,下同)。
按物质的量之比1:3投料发生反应①,下列不能说明反应已达到平衡的是_______(填字母,下同)。
II.已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
(3)在恒容密闭容器中发生反应⑤,达到平衡后升高温度,下列说法正确的是_______ 。
a.平衡正向移动
b.混合气体的平均相对分子质量增大
c.CO2的转化率增大
(4)500℃时测得反应⑥在某时刻下 、
、 、
、 、
、 的浓度(
的浓度( )分别为0.2、0.1、0.01、0.2,则此时
)分别为0.2、0.1、0.01、0.2,则此时
_______ (填“>”“<”或“=”) 。
。
III.用电解法可将CO2转化为多种燃料,原理如图所示。

(5)若阴极只生成CO、HCOOH、 ,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的
,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的 的体积比为
的体积比为_______ 。
I.工业上CO2经催化加氢可以生成多种低碳有机物:
①


②


③


回答下列问题:
(1)反应③的
 为
为(2)在绝热恒容的密闭容器中,将CO2和
 按物质的量之比1:3投料发生反应①,下列不能说明反应已达到平衡的是_______(填字母,下同)。
按物质的量之比1:3投料发生反应①,下列不能说明反应已达到平衡的是_______(填字母,下同)。| A.体系的温度保持不变 |
B.CO2和 的转化率相等 的转化率相等 |
C.单位时间体系内减少3 mol  的同时有1 mol 的同时有1 mol  增加 增加 |
D.合成 的反应限度达到最大 的反应限度达到最大 |
II.已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
④ |  | 2.5 | 0.15 |
⑤ |  | 1.0 | 2.50 |
⑥ |  | ||
a.平衡正向移动
b.混合气体的平均相对分子质量增大
c.CO2的转化率增大
(4)500℃时测得反应⑥在某时刻下
 、
、 、
、 、
、 的浓度(
的浓度( )分别为0.2、0.1、0.01、0.2,则此时
)分别为0.2、0.1、0.01、0.2,则此时
 。
。III.用电解法可将CO2转化为多种燃料,原理如图所示。

(5)若阴极只生成CO、HCOOH、
 ,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的
,且各产物生成速率相同,则相同条件下,Pt电极产生的O2与Cu电极上产生的 的体积比为
的体积比为
您最近一年使用:0次



