名校
1 . 草酸(H2C2O4)是一种常见二元弱酸,易溶于水,常用来做还原剂、沉淀剂、媒染剂、络合剂等。某化学学习兴趣小组欲制备草酸并探究其某些化学性质,经查找资料:乙炔在45-55℃硝酸汞作催化剂的条件下,经浓硝酸氧化可制得草酸。
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称_______
(2)实验室制乙炔时用饱和食盐水代替水的目的是。_______ 。反应时C中产生大量红棕色气体,请写出C中发生化学反应方程式_______ 。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式_______ ,判断到达滴定终点的现象是_______ 。
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为_______ (用a、v表示)
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸_______ (填酸性、氧化性或还原性)
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
[草酸的制备]
甲同学以电石(主要成分CaC2)、浓硝酸及少量硝酸汞为原料,利用如图装置制备草酸。

(1)仪器a的名称
(2)实验室制乙炔时用饱和食盐水代替水的目的是。
[产品中草酸晶体(H2C2O4·2H2O)质量分数的测定]
乙同学准确称取ag产品,配成100mL水溶液,取20mL所配制的溶液置于锥形瓶内,用cmol·L-1酸性KMnO4标准溶液滴定至终点,平行实验三次,平均消耗标准溶液vmL。试回答:
(3)上述滴定实验中发生的离子反应方程式
(4)产品中草酸晶体(H2C2O4·2H2O)的质量分数为
[草酸的性质]
(5)上述酸性高锰酸钾与草酸反应,体现了草酸
(6)室温下已知:Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.5×104,通过下列实验探究草酸的性质。[1g2=0.3,lg3=0.5]。向10mL0.1mol/LH2C2O4溶液中逐滴加入VmL0.1mol/LNaOH溶液,当V从0逐渐增大至20时,测得混合溶液的pH逐渐增大,下列说法正确的是_______(填字母)
A.当V=10时,溶液中离子浓度关系:c(Na+)>c(HC2O )>c(C2O )>c(C2O )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.当溶液中c(C2O )=c(HC2O )=c(HC2O )时,混合溶液的pH约为3.8 )时,混合溶液的pH约为3.8 |
C.当溶液中c(C2O )+c(HC2O )+c(HC2O )=c(Na+)时,混合溶液的pH=7 )=c(Na+)时,混合溶液的pH=7 |
D.当溶液中c(Na+)=2c(C2O )+2c(HC2O )+2c(HC2O )+2c(H2C2O4)时,混合溶液的pH>7 )+2c(H2C2O4)时,混合溶液的pH>7 |
您最近一年使用:0次
2022-04-17更新
|
459次组卷
|
4卷引用:江西省上饶市六校2022届高三第二次联考理科综合化学试题
江西省上饶市六校2022届高三第二次联考理科综合化学试题(已下线)化学(辽宁A卷)-学易金卷:2023年高考第一次模拟考试卷辽宁省葫芦岛市第一高级中学2022-2023学年高三上学期期末线上教学阶段检测化学试题湖南省邵阳市第一中学2023届高三第五次月考化学试题
名校
解题方法
2 . 下列说法正确的有
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
| A.4个 | B.5个 | C.6个 | D.7个 |
您最近一年使用:0次
2021-12-03更新
|
348次组卷
|
2卷引用:江西省丰城中学2022-2023学年高一上学期期中考试化学试题(创新班)
3 . 亚硝酸钠(俗称工业盐)是一种防腐剂。某小组拟利用实验室制备硝酸铜的尾气为原料制备亚硝酸钠,简易流程如图:

请回答下列问题:
(1) 中N元素化合价为
中N元素化合价为_______ 。
(2)“酸溶池”中铜和硝酸反应,如果生成的NO、 体积比为1∶1,则发生反应的离子方程式为
体积比为1∶1,则发生反应的离子方程式为_______ 。通常将铜片剪成碎片,其目的是_______ 。
(3)“酸溶池”中在一定浓度的硝酸中,铜溶解速率与温度关系如图所示。温度高于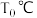 时,铜溶解速率急剧降低,其主要原因是
时,铜溶解速率急剧降低,其主要原因是_______ 。如果利用铜和硝酸反应的原理构成原电池,负极反应式为_______ 。

(4)“碱吸收池”中反应主要有:
①
②
通入气体中
_______ 1时(填“大于”“小于”或“等于”),产品纯度最高且不产生大气污染物。
(5)为了探究 的性质,设计如下实验:
的性质,设计如下实验:
由此推知, 具有的性质是_______(填字母)。
具有的性质是_______(填字母)。
(6)测定 产品纯度。准确称取W g产品溶于水配制250mL溶液,准确量取25.00mL配制溶液于锥形瓶,滴加适量稀硫酸,用
产品纯度。准确称取W g产品溶于水配制250mL溶液,准确量取25.00mL配制溶液于锥形瓶,滴加适量稀硫酸,用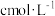 标准
标准 溶液滴定至完全反应时恰好消耗标准溶液V mL。该产品中
溶液滴定至完全反应时恰好消耗标准溶液V mL。该产品中 质量分数为
质量分数为_______ 。(用含c、V、W的代数式表示,滴定反应: )
)

请回答下列问题:
(1)
 中N元素化合价为
中N元素化合价为(2)“酸溶池”中铜和硝酸反应,如果生成的NO、
 体积比为1∶1,则发生反应的离子方程式为
体积比为1∶1,则发生反应的离子方程式为(3)“酸溶池”中在一定浓度的硝酸中,铜溶解速率与温度关系如图所示。温度高于
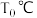 时,铜溶解速率急剧降低,其主要原因是
时,铜溶解速率急剧降低,其主要原因是
(4)“碱吸收池”中反应主要有:
①

②

通入气体中

(5)为了探究
 的性质,设计如下实验:
的性质,设计如下实验:| 实验 | 操作 | 现象 |
| ① | 向 溶液中滴加稀硫酸和KI淀粉溶液 溶液中滴加稀硫酸和KI淀粉溶液 | 溶液变蓝色 |
| ② | 在酸性 溶液中滴加足量的 溶液中滴加足量的 溶液,振荡 溶液,振荡 | 溶液褪色 |
 具有的性质是_______(填字母)。
具有的性质是_______(填字母)。| A.氧化性 | B.还原性 |
| C.既有氧化性,又有还原性 | D.既无氧化性,又无还原性 |
 产品纯度。准确称取W g产品溶于水配制250mL溶液,准确量取25.00mL配制溶液于锥形瓶,滴加适量稀硫酸,用
产品纯度。准确称取W g产品溶于水配制250mL溶液,准确量取25.00mL配制溶液于锥形瓶,滴加适量稀硫酸,用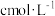 标准
标准 溶液滴定至完全反应时恰好消耗标准溶液V mL。该产品中
溶液滴定至完全反应时恰好消耗标准溶液V mL。该产品中 质量分数为
质量分数为 )
)
您最近一年使用:0次
名校
4 . 高铜酸钾是一种难溶于水的黑色粉末状固体,与高铁酸钾性质相似。可以由四羟基合铜酸钾和次溴酸在冰水浴中合成:①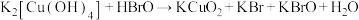 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是
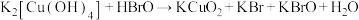 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是| A.①中氧化剂和还原剂的物质的量之比为1:2 |
B.②若有标况下5.6L 生成,转移电子 生成,转移电子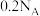 |
C.②中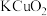 既表现氧化性,又表现还原性 既表现氧化性,又表现还原性 |
D.由①②可知氧化性强弱顺序为: |
您最近一年使用:0次
2022-06-07更新
|
963次组卷
|
6卷引用:江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题
江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题山东省德州市2022届高考三模化学试题(已下线)1.3.2 氧化性、还原性强弱的判断(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题
名校
5 . 下图为碳与浓硫酸反应产物的探究实验,下列分析正确的是


| A.碳与浓硫酸的反应体现了浓硫酸的酸性、强氧化性、脱水性 |
B.Ⅰ、Ⅱ中溶液褪色体现了 的还原性 的还原性 |
| C.Ⅲ中溶液会产生白色沉淀 |
D.浓硫酸氧化性强,不可干燥还原性气体 |
您最近一年使用:0次
2022-10-12更新
|
327次组卷
|
4卷引用:江西百校联盟2023届高三上学期10月联考化学试题
名校
6 . 用覆铜板制作印刷电路板的原理是:利用 FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀。为了减少污染并变废为宝,实现资源的合理利用,现对使用后的“腐蚀液”处理流程如图:

请回答下列问题:
(1)用氯化铁溶液刻蚀覆铜板制作印刷电路板体现了 Fe3+的_______ (填“还原性”或“氧化性”)发生反应的离子方程式为_______ 。
(2)“溶液 1”即为“使用后的腐蚀液”,其中含有的金属阳离子有_______ 。
(3)“操作 a”为_______ ,“固体”的成分为_______ (填化学式)。
(4)如何检验“溶液 2”中不含 Fe3+_______ 。
(5)若“试剂①”为氯水,则“溶液 2” 转化为“溶液 3”的离子方程式为_______ 。
(6)H2O2是一种常用的绿色氧化剂。将“试剂①”改为 H2O2,酸性条件下也能实现“溶液 2” 转化为“溶液 3”,则发生反应的离子方程式为_______

请回答下列问题:
(1)用氯化铁溶液刻蚀覆铜板制作印刷电路板体现了 Fe3+的
(2)“溶液 1”即为“使用后的腐蚀液”,其中含有的金属阳离子有
(3)“操作 a”为
(4)如何检验“溶液 2”中不含 Fe3+
(5)若“试剂①”为氯水,则“溶液 2” 转化为“溶液 3”的离子方程式为
(6)H2O2是一种常用的绿色氧化剂。将“试剂①”改为 H2O2,酸性条件下也能实现“溶液 2” 转化为“溶液 3”,则发生反应的离子方程式为
您最近一年使用:0次
7 . 化学上常用标准电极电势数据φθ(氧化型/还原型)比较物质氧化能力。φθ值越高,氧化型物质氧化能力越强,φθ值与体系pH有关。利用表格所给数据分析,以下说法错误的是
| 氧化型/还原型 | φθ(Co3+/Co2+) | φθ(HClO/Cl— |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φθ[Co(OH)3/Co(OH)2] | φθ(ClO—/Cl—) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
2022-02-22更新
|
2300次组卷
|
14卷引用:江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题
江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题河南省信阳市2022届高三第二次质量检测化学试题(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)广东省广州市真光中学2022-2023学年高一上学期期中考化学试题湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题河北省衡水中学2023届高三上学期三调考试化学试题辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期第二次统测化学试卷 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
名校
8 . 回答以下问题:
(1)下列描述的分别是胶体的性质或现象,按要求填空:
A.胶体的聚沉 B.胶体的电泳 C.丁达尔现象 D.胶体的稳定性
①用激光鉴别胶体和溶液,利用的胶体性质是____ (填字母)。
②工厂采用高压静电除尘,利用的胶体性质是_____ (填字母)。
(2)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,是一元弱酸,NaH2PO2属于____ (正盐、酸式盐、碱式盐),写出NaH2PO2的电离方程式____ 。
(3)已知:氧化性Cl2>Fe3+>I2,请写出过量Cl2通入到FeI2溶液中的化学方程式____ 。
(1)下列描述的分别是胶体的性质或现象,按要求填空:
A.胶体的聚沉 B.胶体的电泳 C.丁达尔现象 D.胶体的稳定性
①用激光鉴别胶体和溶液,利用的胶体性质是
②工厂采用高压静电除尘,利用的胶体性质是
(2)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,是一元弱酸,NaH2PO2属于
(3)已知:氧化性Cl2>Fe3+>I2,请写出过量Cl2通入到FeI2溶液中的化学方程式
您最近一年使用:0次
9 . 某化学兴趣小组探究SO2与Ca( NO3)2溶液的反应。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是_______ (写名称) 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是_______ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究SO 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象可得出对SO2氧化起主要作用的是_______ (填O2或NO ),其理由是
),其理由是_______ 。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
| A.易沉淀固体 | B.胶状物质 | C.大颗粒沉淀 | D.絮状物质 |
实验三:探究SO
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象可得出对SO2氧化起主要作用的是
 ),其理由是
),其理由是
您最近一年使用:0次
2022-02-17更新
|
614次组卷
|
2卷引用:江西省九江市2022届高三第一次高考模拟统一考试理综化学试题
解题方法
10 . 我国科学家放大 身份识别,快速锁定大气污染“元凶”,快速检测
身份识别,快速锁定大气污染“元凶”,快速检测 ,助力北京冬奥会精准预报天气。下列有关
,助力北京冬奥会精准预报天气。下列有关 的说法错误的是
的说法错误的是
 身份识别,快速锁定大气污染“元凶”,快速检测
身份识别,快速锁定大气污染“元凶”,快速检测 ,助力北京冬奥会精准预报天气。下列有关
,助力北京冬奥会精准预报天气。下列有关 的说法错误的是
的说法错误的是A. 既有氧化性又有还原性 既有氧化性又有还原性 | B.实验室用水吸收尾气中 |
C.常温常压下 是红棕色气体 是红棕色气体 | D.汽车尾气和硝酸厂废气都含有 |
您最近一年使用:0次
2022-05-22更新
|
181次组卷
|
4卷引用:江西省部分名校2021-2022学年高一下学期5月调研联考化学试题



