1 .  常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是
。下列说法错误的是
 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是
。下列说法错误的是A.产生22.4L(标准状况) 时,反应中转移 时,反应中转移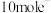 |
| B.反应中氧化剂和还原剂的物质的量之比为11:6 |
C.可用石灰乳吸收反应产生的 制备漂白粉 制备漂白粉 |
D.可用酸化的淀粉碘化钾溶液检验食盐中 的存在 的存在 |
您最近一年使用:0次
2021-06-09更新
|
15659次组卷
|
75卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)辽宁省凌源市2021-2022学年高三下学期高三开学考试化学试题河南省顶尖名校联盟2021-2022学年高二下学期联赛考试化学试题(已下线)卷06 氧化还原-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题04 氧化还原反应-三年(2020-2022)高考真题分项汇编(已下线)微专题10 “守恒法”在氧化还原反应计算中的应用-备战2023年高考化学一轮复习考点微专题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第03讲 氧化还原反应(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河南省濮阳市第一高级中学2023届高三第一次质量检测化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题第二章 海水中的重要元素——钠和氯 ★综合拔高练江苏省南通市通州区金沙中学2021-2022学年高一上学期1月学业水平调研化学试题江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题湖南省常德市桃源县第一中学2022-2023学年高三上学期9月月考化学试题河北省石家庄市第四中学2022-2023学年高三上学期十月月考化学试题安徽省六安市新安中学2022-2023学年高三上学期第二次月考化学试题(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题湖南省长沙市同升湖实验学校2022-2023学年高三上学期第三次月考化学试题安徽省宿城第一中学2022-2023学年高一上学期阶段检测化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省株洲市九方中学2022-2023学年高一上学期第三次月考化学试题北京工业大学附属中学2022-2023学年高三上学期开学测试化学试题2021年新高考湖南化学高考真题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)课时09 氧化还原反应概念及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向05 氧化还原反应-备战2022年高考化学一轮复习考点微专题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题11 富集在海水中的元素——氯 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第5讲 氧化还原反应(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山东省济宁市实验中学2022届高三上学期开学考试化学试题湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题安徽省合肥市第九中学2022届高三第一次阶段测验化学试卷江西省赣州市第十四中学2022届高三上学期第二次月考化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题山西省运城市2021-2022学年高三上学期期中考试化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)吉林省东北师范大学附属中学2021-2022学年高三上学期一模考试化学试题甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题天津市第一中学2021-2022学年高三上学期第二次月考化学试题2021年湖南省高考化学试卷变式题1-10(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题河南省名校联盟2021-2022学年高三上学期第三次诊断考试化学试题四川省广元市树人中学2021-2022学年高三上学期第二次段考化学试题广西钟山县钟山中学2021-2022学年高二上学期第一次(9月)月考化学(文科)试题(已下线)专题07 氧化还原反应分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题卷07 氧化还原反应的概念、规律及应用-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题09 氧化还原反应(已下线)专题09 氧化还原反应(已下线)第5讲 氧化还原反应方程式的配平与计算(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测必修第一册第一单元03巩固练(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)云南省开远市第一中学校2022-2023学年高二下学期5月月考化学试题广东省台山市第一中学2023-2024学年高三上学期第一次月考化学试题广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题吉林省长春外国语学校2023-2024学年高三上学期9月月考化学试题辽宁省沈阳市新民市高级中学2023-2024学年高三上学期10月月考化学试题广东省惠州市博罗县博师高级中学2023-2024学年高三上学期9月月考化学试题福建省厦门第六中学2023-2024学年高一上学期1月月考化学试题甘肃省天水市甘谷县第三中学2023-2024学年高一上学期12月第三次月考化学试卷(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
2 . 一种麻醉剂的分子结构式如图所示。其中, 的原子核只有1个质子;元素
的原子核只有1个质子;元素 、
、 、
、 原子序数依次增大,且均位于
原子序数依次增大,且均位于 的下一周期;元素
的下一周期;元素 的原子比
的原子比 原子多8个电子。下列说法不正确的是
原子多8个电子。下列说法不正确的是
 的原子核只有1个质子;元素
的原子核只有1个质子;元素 、
、 、
、 原子序数依次增大,且均位于
原子序数依次增大,且均位于 的下一周期;元素
的下一周期;元素 的原子比
的原子比 原子多8个电子。下列说法不正确的是
原子多8个电子。下列说法不正确的是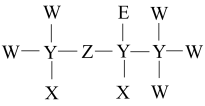
A. 是一种强酸 是一种强酸 |
B.非金属性: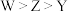 |
C.原子半径: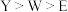 |
D. 中, 中, 的化合价为+2价 的化合价为+2价 |
您最近一年使用:0次
2021-06-11更新
|
15902次组卷
|
48卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)专题09 物质结构 元素周期律-2022年高考化学二轮复习重点专题常考点突破练(已下线)卷08 元素周期律-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷06 物质结构和元素周期律综合推断-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)秘籍09 位、构、性的关系-备战2022年高考化学抢分秘籍(全国通用)山东省烟台市第二中学2021-2022学年高一下学期4月月考化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)广东省佛山市顺德区容山中学2021-2022学年高一下学期期中化学试题(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编广东省揭阳市惠来县第一中学2021-2022学年高一下学期第二次阶段考试化学试题四川省遂宁市射洪中学2021-2022学年高二下学期第三次月考化学试题河南省信阳高级中学2021-2022学年高一下学期第四次月考化学试题(已下线)第10练 元素周期律-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题31 元素推断的破解-备战2023年高考化学一轮复习考点微专题(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省鹤岗市第一中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点14 元素周期表和元素周期律-备战2023年高考化学考试易错题北京市北京一零一中学2022-2023学年高三上学期统练7化学试题2021年新高考广东化学高考真题(已下线)课时26 元素周期表(律)及其应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题讲座(三)“位-构-性”综合推断题的解题方法(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向16 元素周期表 元素周期律-备战2022年高考化学一轮复习考点微专题广东省开平市忠源纪念中学2022届高三复习第一次考试化学试题内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题05 元素周期律-【微专题·大素养】备战2022年高考化学讲透提分要点(已下线)专题05 物质结构和元素周期律-备战2022年高考化学学霸纠错(全国通用)2021年广东省高考化学试卷变式题11-21陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)黑龙江省哈尔滨市第三中学2021-2022学年上学期高三第三次验收考试化学试题(已下线)专题07 元素周期律与元素周期表(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第一部分 二轮专题突破 专题9 “位—构—性”综合推断(已下线)专题12 元素周期律推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)题型10 物质结构与性质的综合分析与推断-高考必备50个题型(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)云南省丽江市第一高级中学2022-2023学年高一下学期期末考试化学试题(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)吉林省长春外国语学校2023-2024学年高一下学期开学化学试题江西省宜春市丰城市第九中学2023-2024学年高一上学期期末考试化学试题广东省珠海市第三中学2023-2024学年高二下学期3月月考化学试卷云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学广东省汕头市潮阳第一中学2023-2024学年高一下学期4月期中考试化学试题
真题
名校
3 . 陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是
| A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 |
| B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 |
| C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 |
| D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 |
您最近一年使用:0次
2019-06-09更新
|
22577次组卷
|
96卷引用:广东省汕头市潮阳区河溪中学2022-2023学年高二上学期化学竞赛试题
广东省汕头市潮阳区河溪中学2022-2023学年高二上学期化学竞赛试题吉林省抚松县泉阳镇抚松县第六中学2021-2022学年高二上学期化学与生活知识竞赛化学试题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)福建省厦门双十中学2021-2022学年高一下学期第一次月考化学试题课中-5.3 无机非金属材料-人教2019必修第二册(已下线)押全国卷理综第7题 化学与社会生产生活及传统文化-备战2022年高考化学临考题号押题(课标全国卷)(已下线)回归教材重难点01 化学与STSE与传统文化-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)广东省大联考2021-2022学年高一下学期期中检测化学试题(已下线)查补易混易错点03 常见无机化合物及其应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)云南省昆明市云南师范大学附属中学2021-2022学年高一下学期期中考试化学试题黑龙江省双鸭山市集贤县2021-2022学年高一下学期期中考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题(已下线)专题01STSE化学用语-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题01 “话”中有“化”—化学与传统文化-备战2023年高考化学一轮复习考点微专题(已下线)考点12 硅及其无机非金属材料-备战2023年高考化学一轮复习考点帮(全国通用)福建省福州市八县(市)协作校2021-2022学年高一下学期期末联考化学试题(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)四川省宜宾市叙州区第一中学校2021-2022学年高一下学期期中考试化学试题(已下线)第09讲 无机非金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)甘肃省临夏州积石中学2021-2022学年高一下学期第一次月考化学试题安徽省合肥市第一中学2022-2023 学年高一下学期第三次素质拓展训练化学试题2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题01 STSE 化学用语——2019年高考真题和模拟题化学分项汇编河南省南阳市第一中学2018-2019学年高一下学期第六次月考化学试题(已下线)专题2.1 物质的组成、性质及分类(讲)-《2020年高考一轮复习讲练测》安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题福建省莆田市莆田第二十五中学2020届高三上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练7 非金属及其化合物甘肃省天水市甘谷第一中学2020届高三上学期第四次检测考试化学试题步步为赢 高一化学寒假作业:作业十二 无机非金属材料的主角——硅专题3.2 非金属及其化合物(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)【新东方】2020-90人教版(2019)必修第二册第五章 模拟高考(已下线)【新东方】2020-89天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题一 化学与STSE(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训江苏省苏州新草桥中学2020届高三上学期10月月考化学试题(已下线)2020年高考化学押题预测卷01(新课标Ⅰ卷)--《2020年高考押题预测卷》(已下线)专题4.1 碳、硅及其无机非金属材料 (讲)——2020年高考化学一轮复习讲练测(已下线)专题4.1 碳、硅及其无机非金属材料 (练)——2020年高考化学一轮复习讲练测江西省宜春市宜丰县宜丰中学2019-2020学年高一下学期第一次月考化学试题模拟卷02——2020年秋高二化学开学摸底考试卷(全国通用)(已下线)第13讲 碳、硅及无机非金属材料(精讲)——2021年高考化学一轮复习讲练测广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题(已下线)小题必刷17 碳、硅与无机非金属材料——2021年高考化学一轮复习小题必刷(通用版)必修第二册RJ第5章挑战区 模拟高考江西省九江市浔阳区九江市第七中学2021届高三上学期期中考试化学试题(已下线)4.1.2 硅酸盐和硅单质(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)练习15 无机非金属材料-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)专题9 第一~三单元综合拔高练-高中化学必修第二册苏教版2019(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第三节 无机非金属材料人教版2019必修第二册 第五章 第二~三节综合拔高练(已下线)专题01 物质的组成、性质和分类——备战2021年高考化学纠错笔记(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练青海省湟川中学2020-2021学年高二下学期第一次月考化学试题(已下线)小题01 化学与传统文化——备战2021年高考化学经典小题考前必刷(全国通用)湖南省常德市芷兰实验中学2020-2021学年高一下学期第一次月考化学试题山西省实验中学2020-2021学年高一下学期第一次月考化学试题湖北省宜昌英杰学校2020-2021学年高一下学期3月测试化学试题黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题广东省肇庆市高要区第二中学2020-2021学年高一下学期段考(一)化学试题(已下线)押全国卷理综第7题 化学与社会生产生活-备战2021年高考化学临考题号押题(课标全国卷)黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题河北省衡水市安平中学2020-2021学年高一下学期第一次月考化学试题河北省衡水市武强中学2020-2021学年高一下学期第一次月考化学试题吉林省大安市第六中学2020-2021学年高一下学期期中化学试题河北省三河市第一中学2020-2021学年高一下学期第一次阶段考化学试题广东省广州市北大附中为明广州实验学校2020-2021学年高一下学期3月月考化学试题(已下线)第11讲 碳、硅及无机非金属材料(精讲)-2022年一轮复习讲练测(已下线)第9讲 无机非金属材料 (讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向10 碳、硅及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)第四单元 非金属及其化合物(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题(已下线)专题讲座(七) STSE与 化学可持续发展(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-练习陕西省西安市鄠邑区第二中学2021-2022学年高三上学期第二次月考化学试题(已下线)第一部分 二轮专题突破 专题7 化学与传统文化第四章 非金属及其化合物 第17讲 无机非金属材料(已下线)题型69 无机非金属材料的性质及应用黑龙江省大庆市第四中学2018-2019学年高二下学期第三次月考化学试题陕西省横山清源中学2022-2023学年高一下学期3月月考化学试题陕西省西安市大联考2022-2023学年高一下学期4月期中考试化学试题(已下线)专题01 化学与STSE广东省梅州市梅雁中学2022-2023学年高一下学期3月月考化学试题广东省深圳聚龙科学中学2022-2023学年高一下学期第一次段考(学业水平)化学试题陕西省西安市蓝田县城关中学玉山中学大学区联考2022-2023学年高一下学期4月期中考试化学试题(已下线)第7讲 碳、硅及无机非金属材料(已下线)T7-化学与STSE陕西省西安市大联考2022-2023学年高二下学期4月期中考试化学试题云南省开远市第一中学校2022-2023学年高一下学期3月月考化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高三上学期11月期中考试化学试题江西省南昌十九中2022-2023学年高一下学期3月第一次月考化学试卷5.3.1 传统无机非金属材料 随堂练习青海省西宁市第五中学2023-2024学年高一下学期4月月考化学试题
4 . 关于反应 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 是氧化产物 是氧化产物 |
B.生成1mol 时,转移3.75mol电子 时,转移3.75mol电子 |
| C.氧化产物与还原产物的物质的量之比为3∶5 |
D. 只是还原产物 只是还原产物 |
您最近一年使用:0次
2022-05-19更新
|
2267次组卷
|
7卷引用:甘肃省武威第七中学2021-2022学年高一下学期学科竞赛化学试题
甘肃省武威第七中学2021-2022学年高一下学期学科竞赛化学试题浙江省Z20名校联盟(名校新高考研究联盟)2022届高三第三次联考化学试题(已下线)第06讲 氧化还原反应(讲)-2023年高考化学一轮复习讲练测(全国通用)浙江省Z20名校联盟2022届高三第三次联考化学试题辽宁省大连市育明高级中学2022-2023学年高一上学期期中考试化学试题广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题6-10)
名校
解题方法
5 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
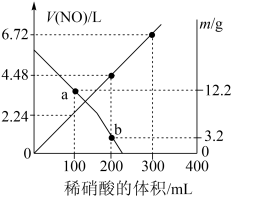

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3636次组卷
|
14卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题山西省长治市2021-2022学年高一下学期期末联合考化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
名校
6 . 利喘贝是一种新的平喘药,其合成过程如下:
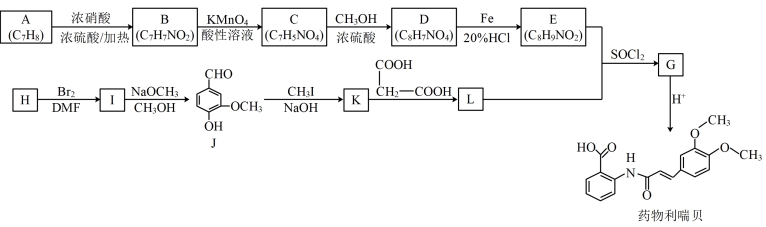
已知:
i. + CH3I
+ CH3I
 +NaI+H2O
+NaI+H2O
ii. R1−CHO R1−CH=CH−COOH
R1−CH=CH−COOH
(1)A属于芳香烃,则A的名称为_______ ;
(2)E的官能团的名称是_______ ;D→E的反应类型是_______ ;
(3)H与FeCl3作用显色且能发生银镜反应,苯环上的一氯代物有两种。由H生成I反应的化学方程式为_______ ;
(4)L的结构简式为_______ 。
(5)J俗称香兰素,在食品行业中主要作为−种增香剂。香兰素的一种合成路线如下。
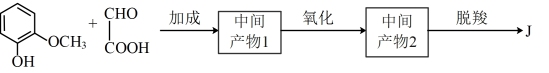
中间产物1和中间产物2的结构简式分别为_______ ;_______ 。

已知:
i.
 + CH3I
+ CH3I
 +NaI+H2O
+NaI+H2Oii. R1−CHO
 R1−CH=CH−COOH
R1−CH=CH−COOH(1)A属于芳香烃,则A的名称为
(2)E的官能团的名称是
(3)H与FeCl3作用显色且能发生银镜反应,苯环上的一氯代物有两种。由H生成I反应的化学方程式为
(4)L的结构简式为
(5)J俗称香兰素,在食品行业中主要作为−种增香剂。香兰素的一种合成路线如下。

中间产物1和中间产物2的结构简式分别为
您最近一年使用:0次
2022-04-26更新
|
1971次组卷
|
9卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题北京市延庆区2022届高三一模化学试题内蒙古赤峰二中2021-2022学年高二下学期第一次月考化学试题湖南省邵阳市洞口县第一中学2021-2022学年高三下学期四月月考化学试题(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专项18 有机化学基础综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)2023年北京卷高考真题变式题(有机综合题)
7 . 下列有关物质的性质与用途具有对应关系的是
| A.铝的金属活泼性强,可用于制作铝金属制品 |
| B.氧化铝熔点高,可用作电解冶炼铝的原料 |
| C.氢氧化铝受热分解,可用于中和过多的胃酸 |
| D.明矾溶于水并水解形成胶体,可用于净水 |
您最近一年使用:0次
2020-07-11更新
|
7085次组卷
|
47卷引用:江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题
江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)第5章 金属及其化合物(章末复习)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省鹤岗市第一中学2021-2022学年高二下学期期末考试化学试题第三章 铁金属材料 综合拔高练(已下线)第08讲 金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)甘肃省武威第十八中学2022-2023学年高三上学期第一次诊断化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题北京市昌平区第二中学2022-2023 学年高三上学期期中考试化学试题2020年江苏卷化学高考试题(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第5单元 常见的金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第12讲 镁、铝、铜及其化合物 金属冶炼(精讲)——2021年高考化学一轮复习讲练测四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题黑龙江省哈尔滨市第九中学2021届高三上学期开学考试化学试题(已下线)小题必刷14 铝及其化合物——2021年高考化学一轮复习小题必刷(通用版)河南省三门峡市第一高级中学2021届高三8月开学考试化学试题江西师范大学附属中学2020-2021学年高一上学期12月考试化学试题(已下线)练习12 从铝土矿到铝合金-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)河南省豫南九校2020-2021学年高一上学期第三次联考化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练上海市崇明区2021届高三下学期二模化学试题(已下线)课时16 铝及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向03 物质的组成、性质和分类-备战2022年高考化学一轮复习考点微专题(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铝及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第8讲 金属材料(不锈钢、铝合金、合金)(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江西省赣州市第十四中学2022届高三上学期第二次月考化学试题(已下线)第三单元 金属及其化合物(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)北京市北京中国人民大学附属中学2022届高三10月检测化学试卷(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年江苏卷化学高考真题变式题1-10内蒙古巴彦淖尔市临河区第三中学2021~2022学年高三上学期期中考试化学试题(已下线)专题08 元素及其化合物(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题09 常见金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第三章 金属及其化合物 第15讲 金属材料 金属冶炼(已下线)题型33 铝及其化合物的性质(已下线)专题05 元素化合物性质(已下线)第5讲 金属材料与金属的冶炼(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题1-5陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷江苏省扬州大学附属中学2023-2024学年高二下学期 3月月考化学试卷广东省河源市龙川县第一中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
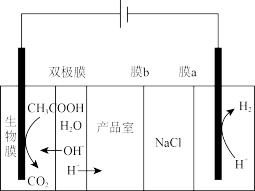
8 . 利用微生物电化学处理有机废水,同时可淡化海水并获得酸碱。现以NaCl溶液模拟海水、采用惰性电极,用如下图所示的装置处理有机废水(以含有机酸 溶液为例),在直流电场作用下,双极膜间的水解离成
溶液为例),在直流电场作用下,双极膜间的水解离成 和
和 。下列说法正确的是
。下列说法正确的是
 溶液为例),在直流电场作用下,双极膜间的水解离成
溶液为例),在直流电场作用下,双极膜间的水解离成 和
和 。下列说法正确的是
。下列说法正确的是
| A.膜a为阴离子交换膜,膜b为阳离子交换膜 |
| B.产品室生成的物质为盐酸 |
| C.当阴极产生22.4L气体时,理论上可除去模拟海水中11.7g NaCl |
D.阳极反应式为: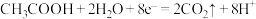 |
您最近一年使用:0次
2022-08-02更新
|
1829次组卷
|
2卷引用:第36届中国化学奥林匹克(初赛)选拔赛暨2022年江苏赛区复赛试题
9 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
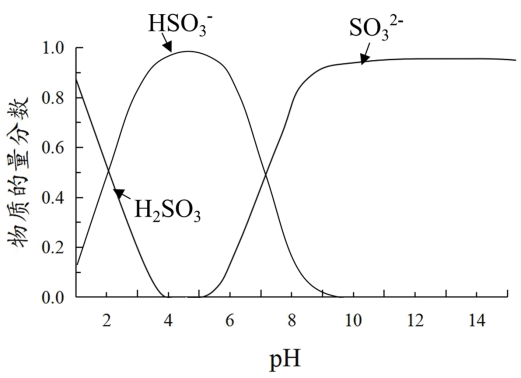
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1807次组卷
|
6卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题天天练6-10
名校
解题方法
10 . 向稀硫酸和稀硝酸的混合溶液200mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是
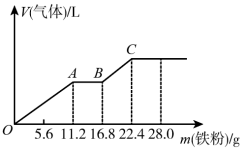

| A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 |
| B.A点溶液中的溶质为FeSO4和H2SO4 |
C.原混合酸中NO 和SO 和SO 物质的量之比为2:1 物质的量之比为2:1 |
| D.原混合酸中H2SO4的物质的量浓度为2mol·L-1 |
您最近一年使用:0次
2022-03-20更新
|
1742次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题



