1 . 羟胺(H2NOH)是一种常见的化工原料,常用于农药制备。实际生产中,羟胺一般会过量加入以保证反应充分进行。因此,羟胺在废水中或多或少都会有残留。通常需要将废水中的羟胺氧化,才能再进行下一步处置。取25.00mL废水样品,加入过量Fe(III)充分反应(反应1),放出笑气,用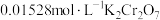 测定产生的Fe(II)(反应2),消耗14.48mL。
测定产生的Fe(II)(反应2),消耗14.48mL。
(1)写出反应1和反应2的方程式___________ 、___________ 。
(2)计算该废水样品中羟胺的浓度___________ 。( )
)
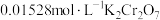 测定产生的Fe(II)(反应2),消耗14.48mL。
测定产生的Fe(II)(反应2),消耗14.48mL。(1)写出反应1和反应2的方程式
(2)计算该废水样品中羟胺的浓度
 )
)
您最近一年使用:0次
解题方法
2 . 水分解制氢是可再生能源领域的重要研究课题,其中一种非常有应用前景的方法是利用热化学循环将水分解成氢气和氧气。直接将水费解成氢气和氧气所需温度很高,利用一些具有氧化还原的物质作为介质,可以构造热化学循环,降低水分解的温度。
(1)经典的S-I循环该热化学物坏以SO2、I2为工质其中第一步反应是SO2、I2和水蒸气反应生成一种含硫的物质A和一种合碘的物质B(反应1),该反应为低温下的放热反应,取少许反应所得溶液加入BaCl2,得到白色沉淀(反应2);而后A在约900℃下发生分解生成氧气(反应3),B在约400℃下即可分解产生氢气(反应4)。反应3和反应4的其他产物可以重新与水反应,实现循环。请写出反应1~4的化学方程式并配平(反应2写离子方程式):___________ 、___________ 、___________ 、___________ 。
(2)氧化物循环体系
S-I循环虽然反应温度较低,但存在中间产物腐蚀性强、产物分离困难等问题。为此,研究者构造了基于可变价氧化物的热化学循环,示意如下(未做配平):
水分解反应:
氧化物还原反应:
(其中MOred代表低价态氧化物,MOox代表高价态氧化物)
总反应:
根据相应反应的Gibbs自由能变随温度的变化,可以判断上述两个反应发生的温度范围,遴选潜在的氧化物体系。下图为H2O、氧化物体系(1)和氧化物体系(2)的生成反应的Gibbs自由能变随温度的变化图,其中M1和M2代指的是两种不同的金属, 表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设
表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设 在整个温度范围内随温度呈线性变化。
在整个温度范围内随温度呈线性变化。

①从热力学上看,氧化物体系(1)和氧化物体系(2)哪一个体系更适用于热化学循环分解水___________ ?简述理由___________ 。
②对于更适用于热化学循环分解水的氧化物体系,说明发生水分解反应和氧化物还原反应对应的温度范围___________ (提示:注意看图并合理做标记,给出简要的文字说明)。
③氧化物循环体系的改进实例I
850℃下Mn3O4在Na2CO3存在下与水反应生成氢气(反应1),获得的固体产物分散在水中,通入CO2进行离子交换, 全部被
全部被 交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:
交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:___________ 、___________ 、___________ 。
④氧化物循环体系的改进实例II
利用金属锂及其氧化物和氢氧化物也可以构成热化学循环,有望进一步降低热化学循环的能耗。其中的一个关键步骤是加热Li2O固体,使之产生两种含锂物质,二者分别通过进一步反应产生氢气和氧气。请写出基于Li的热化学循环分解水制氢反应式并配平___________ 。
(1)经典的S-I循环该热化学物坏以SO2、I2为工质其中第一步反应是SO2、I2和水蒸气反应生成一种含硫的物质A和一种合碘的物质B(反应1),该反应为低温下的放热反应,取少许反应所得溶液加入BaCl2,得到白色沉淀(反应2);而后A在约900℃下发生分解生成氧气(反应3),B在约400℃下即可分解产生氢气(反应4)。反应3和反应4的其他产物可以重新与水反应,实现循环。请写出反应1~4的化学方程式并配平(反应2写离子方程式):
(2)氧化物循环体系
S-I循环虽然反应温度较低,但存在中间产物腐蚀性强、产物分离困难等问题。为此,研究者构造了基于可变价氧化物的热化学循环,示意如下(未做配平):
水分解反应:

氧化物还原反应:

(其中MOred代表低价态氧化物,MOox代表高价态氧化物)
总反应:

根据相应反应的Gibbs自由能变随温度的变化,可以判断上述两个反应发生的温度范围,遴选潜在的氧化物体系。下图为H2O、氧化物体系(1)和氧化物体系(2)的生成反应的Gibbs自由能变随温度的变化图,其中M1和M2代指的是两种不同的金属,
 表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设
表示对应1molO原子(即化学反应式中O2的系数为1/2)时反应的标准Gibbs自由能变,设 在整个温度范围内随温度呈线性变化。
在整个温度范围内随温度呈线性变化。
①从热力学上看,氧化物体系(1)和氧化物体系(2)哪一个体系更适用于热化学循环分解水
②对于更适用于热化学循环分解水的氧化物体系,说明发生水分解反应和氧化物还原反应对应的温度范围
③氧化物循环体系的改进实例I
850℃下Mn3O4在Na2CO3存在下与水反应生成氢气(反应1),获得的固体产物分散在水中,通入CO2进行离子交换,
 全部被
全部被 交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:
交换(反应2),而后将反应所得固体物质在850℃下加热处理再生Mn3O4(反应3)。写出反应1~3的化学方程式并配平:④氧化物循环体系的改进实例II
利用金属锂及其氧化物和氢氧化物也可以构成热化学循环,有望进一步降低热化学循环的能耗。其中的一个关键步骤是加热Li2O固体,使之产生两种含锂物质,二者分别通过进一步反应产生氢气和氧气。请写出基于Li的热化学循环分解水制氢反应式并配平
您最近一年使用:0次
解题方法
3 . 在铋系高温超导材料的探索中,得到样品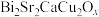 ,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。
,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。
实验A:将102.3mg样品(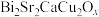 ,式量为760.4+16.00x)溶于100.0mL含有
,式量为760.4+16.00x)溶于100.0mL含有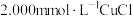 的
的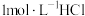 溶液中,以库仑滴定法测定过量的
溶液中,以库仑滴定法测定过量的 ,结果为0.1085mmol。
,结果为0.1085mmol。
实验B:将94.6mg样品溶解于 的酸性溶液中。以库仑滴定法测定过量的
的酸性溶液中。以库仑滴定法测定过量的 ,结果为0.0577mmol。
,结果为0.0577mmol。
(1)写出实验A中样品溶解时涉及氧化还原反应的所有方程式___________ 。
(2)写出实验B中样品溶解时涉及氧化还原反应的所有方程式___________ 。
(3)求算样品中Bi和Cu的氧化数,确定化学式中x的值___________ 。
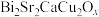 ,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。
,其中Cu可能存在的价态为+2和+3,Bi的可能价态为+3和+5.设计如下实验测定两种元素的平均氧化态。实验A:将102.3mg样品(
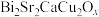 ,式量为760.4+16.00x)溶于100.0mL含有
,式量为760.4+16.00x)溶于100.0mL含有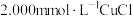 的
的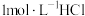 溶液中,以库仑滴定法测定过量的
溶液中,以库仑滴定法测定过量的 ,结果为0.1085mmol。
,结果为0.1085mmol。实验B:将94.6mg样品溶解于
 的酸性溶液中。以库仑滴定法测定过量的
的酸性溶液中。以库仑滴定法测定过量的 ,结果为0.0577mmol。
,结果为0.0577mmol。(1)写出实验A中样品溶解时涉及氧化还原反应的所有方程式
(2)写出实验B中样品溶解时涉及氧化还原反应的所有方程式
(3)求算样品中Bi和Cu的氧化数,确定化学式中x的值
您最近一年使用:0次
解题方法
4 . SO2和S混合物经低压放电得产物A,它在液态空气冷阱中成橘红色液体。A受热生成等物质的量的S和SO2。写出以下两个反应的方程式。
(1)和微量 H2O反应得H2S、S、SO2 (已知有1/5mol的A转化为 S)_______ 。
(2)和金属 M反应生成金属硫化物(设为MS)_______ 。
(1)和微量 H2O反应得H2S、S、SO2 (已知有1/5mol的A转化为 S)
(2)和金属 M反应生成金属硫化物(设为MS)
您最近一年使用:0次
5 . 若以I2(l)为溶剂,下列四个反应中何者为歧化、反歧化、溶剂合、复分解:
(1)KI+IBr=KBr+I2_______
(2)NaCN+I2=NaI+ICN_______
(3)KI+I2=KI3_______
(4)PbC12+2KI=PbI2+2KCl_______
(1)KI+IBr=KBr+I2
(2)NaCN+I2=NaI+ICN
(3)KI+I2=KI3
(4)PbC12+2KI=PbI2+2KCl
您最近一年使用:0次
解题方法
6 . 写出如下反应的离子方程式:
(1)用盐酸滴定碳酸钠溶液,滴定终点为酚酞恰好褪色_______ 。
(2)向氯化银和水的混合物中加入过量的氨水形成Ag(NH3)2Cl,得到澄清的水溶液_______ 。
(3)过量的醋酸和碳酸氢钠反应_______ 。
(4)盐酸滴入固态的漂白粉中_______ 。(注:漂白粉有效成分常用化学式CaCl2·Ca(OC1)2·2H2O表示,化学式不得拆开)
(5)漂白粉固体吸收空气中的二氧化碳放出氯气_______ 。(漂白粉化学式不得拆开)
(6)中药 “生磁石”(主要成分Fe3O4)在热铁锅中边炒边喷醋,磁石中的Fe2O3溶解生成醋酸铁溶于水后洗去得到不含Fe2O3的“生磁石”_______ 。
(1)用盐酸滴定碳酸钠溶液,滴定终点为酚酞恰好褪色
(2)向氯化银和水的混合物中加入过量的氨水形成Ag(NH3)2Cl,得到澄清的水溶液
(3)过量的醋酸和碳酸氢钠反应
(4)盐酸滴入固态的漂白粉中
(5)漂白粉固体吸收空气中的二氧化碳放出氯气
(6)中药 “生磁石”(主要成分Fe3O4)在热铁锅中边炒边喷醋,磁石中的Fe2O3溶解生成醋酸铁溶于水后洗去得到不含Fe2O3的“生磁石”
您最近一年使用:0次
名校
解题方法
7 . 氰化物电镀的废液中含多种金属离子与氰离子(CN-)的络离子,如Cu(CN) 。废液排放前,必须将剧毒的氰离子完全氧化。在废液中加入漂白粉可将这些络离子完全氧化而从废液中除去。完成下列反应方程式:
。废液排放前,必须将剧毒的氰离子完全氧化。在废液中加入漂白粉可将这些络离子完全氧化而从废液中除去。完成下列反应方程式:
(1)氰离子和次氯酸根的反应可按氰离子中的氮呈负氧化态(负价),碳呈正氧化态(正价)进行_______ 。
□CN-+□ClO-+□OH-=□+□+□+□H2O
(2)_______
□Cu(CN) +□ClO-+□OH-=□+□+□+□+□
+□ClO-+□OH-=□+□+□+□+□
在本反应中的得失电子数相等,是_______ 个电子?
 。废液排放前,必须将剧毒的氰离子完全氧化。在废液中加入漂白粉可将这些络离子完全氧化而从废液中除去。完成下列反应方程式:
。废液排放前,必须将剧毒的氰离子完全氧化。在废液中加入漂白粉可将这些络离子完全氧化而从废液中除去。完成下列反应方程式:(1)氰离子和次氯酸根的反应可按氰离子中的氮呈负氧化态(负价),碳呈正氧化态(正价)进行
□CN-+□ClO-+□OH-=□+□+□+□H2O
(2)
□Cu(CN)
 +□ClO-+□OH-=□+□+□+□+□
+□ClO-+□OH-=□+□+□+□+□在本反应中的得失电子数相等,是
您最近一年使用:0次
2021-08-22更新
|
191次组卷
|
2卷引用:2006年北京市高中学生化学竞赛高中一年级试题
8 . A、B两种同族元素,B的原子序数是A的两倍;A与B既可形成BA2型,也可形成BA3型化合物。这两种化合物与水反应生成两种不同的二元酸。试回答下列问题:
(1)A是___________ ,B是___________ ;其原子的电子结构示意图分别为A:___________ ,B:___________ 。
(2)A、B生成BA2化合物的反应___________ ;(配平,并注明条件)
(3)A、B生成BA3化合物的反应___________ ;(配平,并注明条件)
(4)BA2与水的反应方程式___________ ;BA3与水的反应方程式___________ 。
(1)A是
(2)A、B生成BA2化合物的反应
(3)A、B生成BA3化合物的反应
(4)BA2与水的反应方程式
您最近一年使用:0次
9 . 将0.8000g的FeC2O4固体加热至400℃,固体质量变为0.4000g。加热至500℃,固体质量变为0.444g。加热至800℃,固体质量变为0.4296g。在800℃时固体的成分是
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.FeCO3 |
您最近一年使用:0次
2021-08-22更新
|
180次组卷
|
2卷引用:2006年北京市高中学生化学竞赛高中一年级试题
10 . 下列离子方程式正确的是
A.H2O2溶液滴入酸性KMnO4溶液中:2MnO +7H2O2+6H+=2Mn2++6O2↑+10H2O +7H2O2+6H+=2Mn2++6O2↑+10H2O |
B.1mol CO2通入少量的NaOH溶液中:CO2+OH-=CO +H2O +H2O |
C.Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO +2Ca2++4OH-=Mg(OH)2↓+2H2O+2CaCO3↓ +2Ca2++4OH-=Mg(OH)2↓+2H2O+2CaCO3↓ |
| D.向漂白粉溶液中通入SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
您最近一年使用:0次



