名校
1 . 无机化合物可根据其组成和性质进行分类,分类比较是研究物质性质常用的一类方法。
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要分离提取 出砷元素,有同学建议用NaOH溶液,理由是_______ 。
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①_______ ;②2AsH3=2As+3H2
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①
您最近一年使用:0次
名校
2 . 如图是氮元素的几种价态与物质类别的对应关系。回答下列问题:
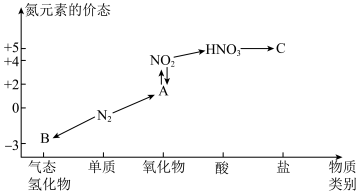
(1)B物质的电子式为:_______ 。
(2)实验室制取物质B的化学方程式为_______ 。
(3)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入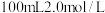 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为_______ 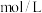 。
。

(1)B物质的电子式为:
(2)实验室制取物质B的化学方程式为
(3)浓硝酸与木炭在加热条件下反应的化学方程式为
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入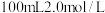 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为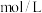 。
。
您最近一年使用:0次
名校
解题方法
3 . 新型冠状病毒可通过气溶胶传播,气溶胶属于胶体的一种。下列有关胶体的叙述正确的是
| A.雾是气溶胶,在阳光下可观察到丁达尔效应 |
| B.将Fe(OH)3胶体过滤,在滤纸上能得到分散质 |
| C.向有污染的水中加入胶体,具有杀菌消毒的作用 |
| D.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色的Fe(OH)3胶体 |
您最近一年使用:0次
4 . 高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ:在用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:
①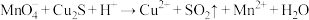 (未配平)
(未配平)
②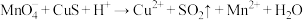 (未配平)
(未配平)
(1)下列关于反应①的说法中错误的是___________ (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下) ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mol
d.还原性的强弱关系是: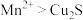
Ⅱ:在稀硫酸中, 与也能发生氧化还原反应。
与也能发生氧化还原反应。
(2)配平 与
与 反应的离子方程式:
反应的离子方程式:___________

(3)欲配制480mL0.1mol/L 溶液,需称取
溶液,需称取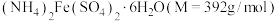 的质量为
的质量为___________ g,需要的玻璃仪器有___________ 。
Ⅲ:实验室可由软锰矿(主要成分为 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和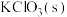 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:
(4)用软锰矿制备 的化学方程式是:
的化学方程式是:___________ 。
(5) 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为___________ 。
Ⅰ:在用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生的反应如下:
和CuS的混合物时,发生的反应如下:①
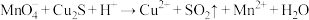 (未配平)
(未配平)②
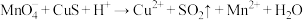 (未配平)
(未配平)(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下)
 ,转移电子的物质的量是0.8mol
,转移电子的物质的量是0.8mold.还原性的强弱关系是:
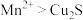
Ⅱ:在稀硫酸中,
 与也能发生氧化还原反应。
与也能发生氧化还原反应。(2)配平
 与
与 反应的离子方程式:
反应的离子方程式:
(3)欲配制480mL0.1mol/L
 溶液,需称取
溶液,需称取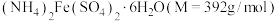 的质量为
的质量为Ⅲ:实验室可由软锰矿(主要成分为
 )制备
)制备 ,方法如下:高温下使软锰矿与过量
,方法如下:高温下使软锰矿与过量 和
和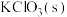 反应,生成
反应,生成 (锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,
(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液, 转化为
转化为 和
和 ;再滤去沉淀
;再滤去沉淀 ,浓缩结晶得到
,浓缩结晶得到 晶体。请回答:
晶体。请回答:(4)用软锰矿制备
 的化学方程式是:
的化学方程式是:(5)
 转化为
转化为 的反应中氧化剂和还原剂的物质的量之比为
的反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
5 . 下列各组溶液,只需组内物质相互反应就能区别的是
A.NaOH、 、NaCl、 、NaCl、 | B. 、 、 、KOH、 、KOH、 |
C. 、 、 、 、 、HCl 、HCl | D. 、KCl、 、KCl、 、 、 |
您最近一年使用:0次
解题方法
6 . 磷酸亚铁锂( )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: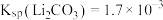
②LiOH、 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:
(1)过程I“碱浸”的目的是___________ 。
(2)若浸出液中存在大量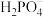 离子,则反应的离子方程式为
离子,则反应的离子方程式为___________ 。
(3)①过程III得到“沉淀Y”的离子方程式为___________ 。
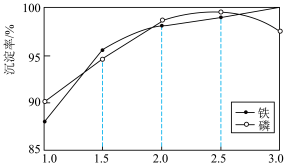
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为___________ 。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为___________ 。___________ 。
A.NaOH20-40℃ B.NaOH80-100℃
C. 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃
②常温下,测得滤液1中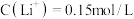 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
___________  。
。
 )为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池,
)为近来新开发的锂离子电池电极材料,主要用于动力锂离子电池, 废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下:
废料中(含Al、石墨),其中磷、铁、锂的综合回收工艺流程图如下: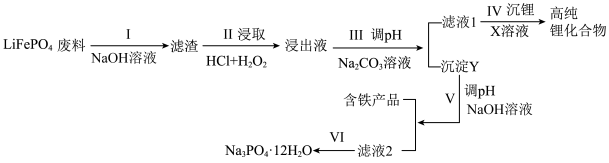
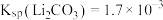
②LiOH、
 的溶解度与温度的关系如下表:
的溶解度与温度的关系如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | LiOH | 11.9 | 12.4 | 13.2 | 14.6 | 16.6 | 19.1 |
 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 | |
(1)过程I“碱浸”的目的是
(2)若浸出液中存在大量
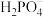 离子,则反应的离子方程式为
离子,则反应的离子方程式为(3)①过程III得到“沉淀Y”的离子方程式为
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如下图所示。由图可知,过程III应选取的最佳沉淀时的pH为
A.NaOH20-40℃ B.NaOH80-100℃
C.
 20-40℃ D.
20-40℃ D. 60-80℃
60-80℃②常温下,测得滤液1中
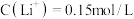 ,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
,某同学取该100ml滤液进行“沉锂”反应。加入50mlX溶液却未见沉淀,若不考虑液体混合时的体积变化,则该同学加入的X溶液最大浓度为
 。
。
您最近一年使用:0次
2023-12-05更新
|
372次组卷
|
3卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题山西运城新康国际中学2023-2024学年高三上学期一轮复习检测化学试卷(已下线)大题01 化工流程综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
7 . 已知:HCl与NH3反应生成固态NH4Cl,CH4不与HCl反应。相同条件下,向如图所示的密闭容器的左边通入1 mol NO,右边通入CH4和HCl的混合气体,若CH4和HCl的物质的量之比为1:4,下列说法错误的是
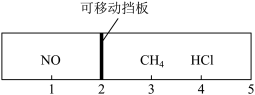

| A.左边与右边的原子个数比为2:3 |
| B.右边混合气体中CH4的物质的量为0.3 mol |
| C.向右边通入0.5 mol NH3时,可移动挡板将移到2.5刻度处 |
D.右边 CH4和HCl的混合气体的平均摩尔质量为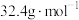 |
您最近一年使用:0次
2023-11-20更新
|
532次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
8 . 取 和
和 组成的混合气体
组成的混合气体 ,通入到盛足量
,通入到盛足量 固体粉末的容器中,并同时加入足量的
固体粉末的容器中,并同时加入足量的 ,电火花引燃,充分反应后,称重发现固体粉末的质量增加了3.6g,则原混合气体中
,电火花引燃,充分反应后,称重发现固体粉末的质量增加了3.6g,则原混合气体中 和
和 质量比为
质量比为
 和
和 组成的混合气体
组成的混合气体 ,通入到盛足量
,通入到盛足量 固体粉末的容器中,并同时加入足量的
固体粉末的容器中,并同时加入足量的 ,电火花引燃,充分反应后,称重发现固体粉末的质量增加了3.6g,则原混合气体中
,电火花引燃,充分反应后,称重发现固体粉末的质量增加了3.6g,则原混合气体中 和
和 质量比为
质量比为| A.7:2 | B.6:5 | C.2:3 | D.1:4 |
您最近一年使用:0次
2023-11-04更新
|
1036次组卷
|
5卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题
名校
解题方法
9 . 下列化学用语正确的是
A.氯化铵的分子式: | B. 的简化电子排布式: 的简化电子排布式: |
C. 的晶胞: 的晶胞: | D. 的VSEPR模型: 的VSEPR模型: |
您最近一年使用:0次
2023-10-31更新
|
268次组卷
|
4卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题
10 . 甘氨酸亚铁晶体是一种新型的固体整合补铁剂。其实验室合成路线为:铁片 FeSO4
FeSO4 FeCO3
FeCO3 甘氨酸亚铁晶体粗品
甘氨酸亚铁晶体粗品 甘氨酸亚铁晶体纯品。
甘氨酸亚铁晶体纯品。
已知:相关物质的信息如表所示:
(一)FeCO3固体的制备
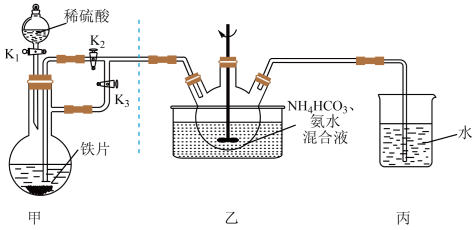
(1)实验开始时应先开K1和________ ,关________ (填“K2”或“K3”)一段时间后,改变开关状态,生成FeCO3。
(2)三颈瓶中生成FeCO3的离子方程式为________ 。
(二)甘氨酸亚铁的制备
(3)用如图装置制备甘氨酸亚铁。反应开始时,先通过滴液口滴入适量的NaOH溶液调节pH为5左右,pH过高或过低都会使产率下降,原因是_________ 。
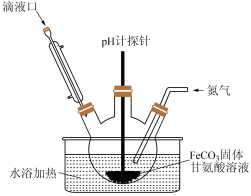
(4)当FeCO3固体完全溶解后,再通过滴液口加入乙醇,其作用是________ 。
(5)反应结束后,过滤出产品粗品,依次用________ 、_______ (填序号)洗涤,再经过一系列操作得纯品。
a.热水 b.冰水 c.乙醇
(三)甘氨酸亚铁晶体结构的分析
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol/LH2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol/L(NH4)2Ce(SO4)3,标准液滴定至终点,用去标准液20.20mL(反应为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
回答下列问题:
(6)甘氨酸亚铁晶体中Fe的质量分数为_________  (保留小数点后一位)。
(保留小数点后一位)。
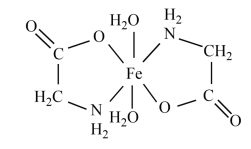
(7)进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+且存在五元整合环,甘氨酸亚铁晶体的结构简式如图所示,则Fe2+的配位数为________ 。
 FeSO4
FeSO4 FeCO3
FeCO3 甘氨酸亚铁晶体粗品
甘氨酸亚铁晶体粗品 甘氨酸亚铁晶体纯品。
甘氨酸亚铁晶体纯品。已知:相关物质的信息如表所示:
| 物质 | 化学式 | 摩尔质量 | 性质 |
| 甘氨酸 | H2NCH2COOH | 75g/mol | 两性物质,易溶于水,微溶于乙醇 |
| 甘氨酸亚铁晶体 | 易溶于水,溶解度随温度升高而增大;难溶于乙醇,在潮湿的空气中易被氯化 |

(1)实验开始时应先开K1和
(2)三颈瓶中生成FeCO3的离子方程式为
(二)甘氨酸亚铁的制备
(3)用如图装置制备甘氨酸亚铁。反应开始时,先通过滴液口滴入适量的NaOH溶液调节pH为5左右,pH过高或过低都会使产率下降,原因是

(4)当FeCO3固体完全溶解后,再通过滴液口加入乙醇,其作用是
(5)反应结束后,过滤出产品粗品,依次用
a.热水 b.冰水 c.乙醇
(三)甘氨酸亚铁晶体结构的分析
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol/LH2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol/L(NH4)2Ce(SO4)3,标准液滴定至终点,用去标准液20.20mL(反应为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
回答下列问题:
(6)甘氨酸亚铁晶体中Fe的质量分数为
 (保留小数点后一位)。
(保留小数点后一位)。(7)进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+且存在五元整合环,甘氨酸亚铁晶体的结构简式如图所示,则Fe2+的配位数为

您最近一年使用:0次
2023-10-04更新
|
106次组卷
|
2卷引用:湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题



