名校
解题方法
1 . 按要求回答下列问题:
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:__________________________________________ ;若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将__________ (填“增加”、“减少”或“不变”)。
(2)已知 的电离平衡常数
的电离平衡常数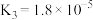 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至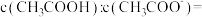 1:18,此时溶液PH=
1:18,此时溶液PH=________ 。
(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
则该反应的热化学反应方程式为:___________________________ 。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_________________________________ 。

(4)已知2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________ 。
③达到平衡后CH3OH的浓度为_____________ 。
(5)制取聚乙二酸乙二酯的反应方程式_______________________________
(6)有一种耐热型树脂材料的结构简式为 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________ 。
(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为_________ 。
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。
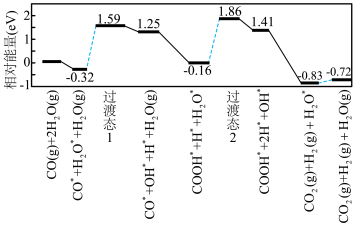
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:_________________________
(10)已知: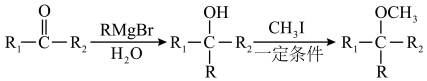 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以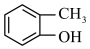 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________ 。
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:
(2)已知
 的电离平衡常数
的电离平衡常数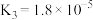 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至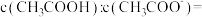 1:18,此时溶液PH=
1:18,此时溶液PH=(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是

(4)已知2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.4 | 0.1 | 0.1 |
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为
③达到平衡后CH3OH的浓度为
(5)制取聚乙二酸乙二酯的反应方程式
(6)有一种耐热型树脂材料的结构简式为
 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。

可知水煤气变换的ΔH
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:
(10)已知:
 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)
您最近一年使用:0次
名校
2 .  、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
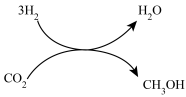
(1)利用 可合成多种化工产品。
可合成多种化工产品。
2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为___________ 。
②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为___________ 。过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( )实现
)实现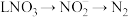 的转化,将
的转化,将 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为___________ 。
(3)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于___________ (填“电解质”或“非电解质”),氨水吸收少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
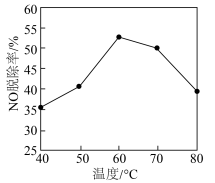
(4)氮的氧化物(NO、 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________ 。
 、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用
 可合成多种化工产品。
可合成多种化工产品。2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现
 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为 )实现
)实现 的转化,将
的转化,将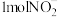 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为(3)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于 ,反应的离子方程式为
,反应的离子方程式为(4)氮的氧化物(NO、
 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
您最近一年使用:0次
名校
解题方法
3 . 硒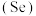 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子IV的合成路线如下:
分子IV的合成路线如下: 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为_______ 。
(2) 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
_______  (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是_______ ;热稳定性:
_______  。
。
(3)研究发现,给小鼠喂食适量硒酸钠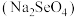 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。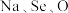 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为_______ 。
(4)反应物III的部分结构与肼 十分相似,
十分相似, 的电子式为
的电子式为_______ 。以 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼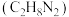 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为_______ 。
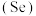 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子IV的合成路线如下:
分子IV的合成路线如下: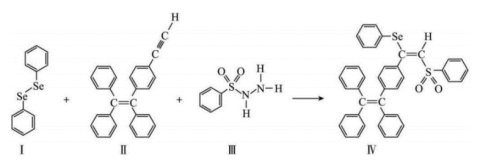
 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为(2)
 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
 (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是
 。
。(3)研究发现,给小鼠喂食适量硒酸钠
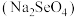 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。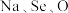 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为(4)反应物III的部分结构与肼
 十分相似,
十分相似, 的电子式为
的电子式为 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼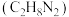 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
2023-03-24更新
|
267次组卷
|
2卷引用:湖北省名校3月联考2022-2023学年高一下学期化学试题
名校
4 . 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为_______ 。
(2)能鉴别和除去甲烷中混有的乙烯的试剂是_______(填序号)。
(3)下列物质不可能是乙烯加成产物的是_______ (填序号)。
a. b.
b. c.
c.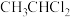 d.
d.
(4) 是一种重要的化工原料,可通过乙烯与氯化氢的加成反应或乙烷与氯气的取代反应制得,你认为哪种方法较好?
是一种重要的化工原料,可通过乙烯与氯化氢的加成反应或乙烷与氯气的取代反应制得,你认为哪种方法较好?_______ ,请说明理由_______ 。
(5)已知 。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:

①反应②的化学方程式为_______ 。工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_______ 。
②有机物B中含有的官能团是_______ (填名称),A与乙酸反应的化学方程式是_______ ,该反应的反应类型是_______ 。
(1)乙烯的结构简式为
(2)能鉴别和除去甲烷中混有的乙烯的试剂是_______(填序号)。
| A.稀硫酸 | B.溴的四氯化碳溶液 |
| C.水 | D.酸性高锰酸钾溶液 |
a.
 b.
b. c.
c.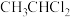 d.
d.
(4)
 是一种重要的化工原料,可通过乙烯与氯化氢的加成反应或乙烷与氯气的取代反应制得,你认为哪种方法较好?
是一种重要的化工原料,可通过乙烯与氯化氢的加成反应或乙烷与氯气的取代反应制得,你认为哪种方法较好?(5)已知
 。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
①反应②的化学方程式为
②有机物B中含有的官能团是
您最近一年使用:0次
2022-06-11更新
|
401次组卷
|
2卷引用:甘肃省天水市第一中学2021-2022学年高一下学期第二阶段考化学试题
名校
解题方法
5 . 电石(主要成分为 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
(1)碳元素在元素周期表中的位置为_______ ; 的电子式为
的电子式为_______ 。
(2)①目前工业上合成电石主要采用氧热法。
已知: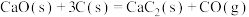
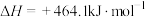 ;
;

 。
。
若不考虑热量耗散,物料转化率均为 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产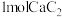 ,投料的量为
,投料的量为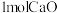 、
、_______ 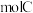 及
及_______ 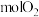 。
。
②制乙炔后的固体废渣主要成分为 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为_______ 。
(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:
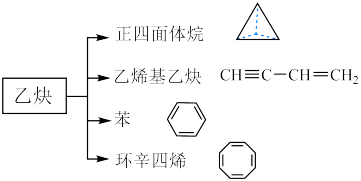
下列说法正确的是_______(填标号)。
(4)以乙炔为原料可制备维尼纶(PVAC),其合成路线如下:
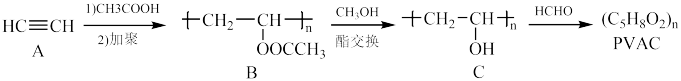
① 中官能团名称为
中官能团名称为_______ 。
② 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为_______ 。
③ 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为_______ 。
 )是重要的基本化工原料,主要用于生产乙炔。回答下列问题:
)是重要的基本化工原料,主要用于生产乙炔。回答下列问题:(1)碳元素在元素周期表中的位置为
 的电子式为
的电子式为(2)①目前工业上合成电石主要采用氧热法。
已知:
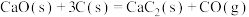
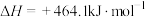 ;
;
 。
。若不考虑热量耗散,物料转化率均为
 ,最终炉中出来的气体只有
,最终炉中出来的气体只有 。则为了维持热平衡,每生产
。则为了维持热平衡,每生产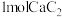 ,投料的量为
,投料的量为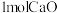 、
、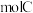 及
及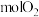 。
。②制乙炔后的固体废渣主要成分为
 ,可用于制取漂白粉,制取漂白粉的化学方程式为
,可用于制取漂白粉,制取漂白粉的化学方程式为(3)乙炔是二种重要的有机化工原料,乙炔在不同的反应条件下可以转化成下列化合物:

下列说法正确的是_______(填标号)。
| A.乙烯基乙炔分子中所有原子可以处于同一直线上 |
B.常温下, 苯中含碳碳双键数目约为 苯中含碳碳双键数目约为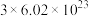 |
| C.环辛四烯与苯均能使酸性高锰酸钾溶液褪色 |
| D.正四面体烷与环辛四烯的一取代物均只有一种 |
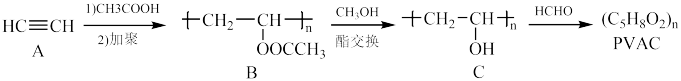
①
 中官能团名称为
中官能团名称为②
 经过两步反应,第二步为加聚反应,第一步反应类型为
经过两步反应,第二步为加聚反应,第一步反应类型为③
 的反应过程中另一种生成物的结构简式为
的反应过程中另一种生成物的结构简式为
您最近一年使用:0次
名校
6 . i. 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
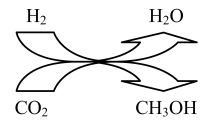
(1)利用 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为_______ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于_______ (填“电解质”或“非电解质”)。
②氨水吸收少量 ,可生成
,可生成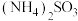 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
ii. 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
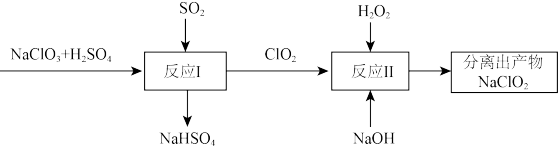
(4)反应I中氧化剂与还原剂的个数之比为_______ 。
(5)写出反应II的化学方程式_______ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的_______ 倍。(以单位质量得到的电子数表示,结果精确到0.01)
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于②氨水吸收少量
 ,可生成
,可生成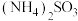 ,反应的离子方程式为
,反应的离子方程式为(3)所得溶液再用
 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为ii.
 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
(4)反应I中氧化剂与还原剂的个数之比为
(5)写出反应II的化学方程式
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的
您最近一年使用:0次
2022-10-12更新
|
522次组卷
|
3卷引用:辽宁省实验中学2022-2023学年高一上学期10月月考化学试题
7 . 乙烯是石油裂解气的主要成分,其产量通常用来衡量一个国家石油化工发展水平。
(1)乙烯的结构简式为____ 。
(2)下列能鉴别甲烷和乙烯的试剂是____ (填序号)。
(3)若以乙烯为主要原料合成乙酸,其合成路线如图所示:
乙烯 A
A B
B 乙酸
乙酸
①B物质官能团的名称是____ 。
②反应II的化学方程式为____ 。
③工业上以乙烯为原料在一定条件下可合成一种重要的有机高分子化合物,该反应的化学方程式为___ 。
(1)乙烯的结构简式为
(2)下列能鉴别甲烷和乙烯的试剂是
| A.稀硫酸 | B.溴的四氯化碳溶液 | C.水 | D.酸性高锰酸钾溶液 |
乙烯
 A
A B
B 乙酸
乙酸①B物质官能团的名称是
②反应II的化学方程式为
③工业上以乙烯为原料在一定条件下可合成一种重要的有机高分子化合物,该反应的化学方程式为
您最近一年使用:0次
解题方法
8 . 随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_____________________ 。
(2)与CO互为等电子体的分子和离子分别为________ 和________ (各举一种即可,填化学式),CO分子的电子式为________ ,CO分子的结构式可表示成________ 。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有___ ,CH3OH的熔、沸点比CH4高,其主要原因是__________ 。
(4)CH3CHO分子中,—CH3中的碳原子采取________ 杂化方式,—CHO中的碳原子采取________ 杂化方式。
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:
(2)与CO互为等电子体的分子和离子分别为
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
(4)CH3CHO分子中,—CH3中的碳原子采取
您最近一年使用:0次
9 . A.《化学与生活》
化学科学与材料、人体健康和环境保护等密切相关。
(1)践行“绿水青山就是金山银山”理念,实现人与自然和谐共生。
①下列做法会加剧雾霾天气的是_____ (填字母)。
a.禁烧秸秆 b.潮汐发电 c.燃煤供暖
②下列污水处理的方法中只涉及物理方法的是_____ (填字母)。
a.活性炭吸附法 b.氧化还原法 c.中和法
③下列措施不 属于城市生活垃圾无害化处理的是_____ (填字母)。
a.封闭式焚烧 b.露天堆放 c.卫生填埋
④处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,发生反应的化学方程式为____________ 。
(2)营养均衡、合理用药是人体健康的保证。
现代医学研究表明,甘蔗中含有丰富的糖分、水分,此外,还含有对人体新陈代谢非常有益的各种维生素、脂肪、蛋白质、有机酸(苹果酸、柠檬酸)、氨基酸、钙、铁、磷、钾、铜、锌、镁、硒等物质。
①钙、锌、磷、钾元素中属于人体所需微量元素的是_____ (填元素符号)。
②人体需要的营养素主要有糖类、油脂、蛋白质、无机盐、维生素和_____ (填名称)。
③_____ (填字母)能促进人体对Ca2+的吸收。
a.维生素A b.维生素C c.维生素D
④甘蔗中所含丝氨酸、赖氨酸为人体自身不能合成,该类氨基酸被称为_____ 氨基酸。
⑤苹果酸、柠檬酸属于_____ (填字母)
a.酸味剂 b.甜味剂 c.着色剂
⑥以下药物可以治疗胃酸分泌过多的是_____ (填字母)。
a.阿司匹林 b.泡腾片 c.复方氢氧化铝片
(3)创新发展材料推动人类社会的进步。2019年1月3日10时26分,由中国航天科技集团有限公司研制的嫦娥四号探测器成功着陆在月球背面预选着陆区。

①嫦娥四号探测器采用大量CFRP(碳纤维增强塑料)。CFRP属于_____ (填字母)。
a.金属材料 b.无机非金属材料 c.复合材料
②嫦娥四号探测器的承力梁采用轻质钛合金构件。下列不 属于钛合金性质的是_____ (填字母)。
a.高强度 b.高密度 c.高韧性
③嫦娥四号探测器的飞行仪表板多采用有机玻璃材料。有机玻璃受热易熔化,易于加工成型,属于_____ (填“热固性”或“热塑性”)塑料。
④机场建设需要大量的钢材、水泥、玻璃等建筑材料,其中生产水泥和玻璃所需的共同原料是_______ (填化学式)
B.有机化学基础
⑴ 根据分子中所含官能团可预测有机化合物的性质。
① 分子中所有原子位于同一条直线上的是_____ (填字母)。
a.乙烷 b.乙烯 c.乙炔
② 能发生水解反应的有机物是_____ (填字母)。
a.CH3CH2Br b.CH3CH2OH c.葡萄糖
③ 鉴别苯与甲苯适宜的试剂是_____ (填字母)。
a.水 b.KMnO4酸性溶液 c.NaOH溶液
④ 下列化合物中,能发生酯化反应的是_____ (填字母)。
a.CH3CHO b.HCOOCH3 c.CH3OH
⑤ 能鉴别 和
和 两种物质的试剂是
两种物质的试剂是_____ (填字母)。
a.FeCl3溶液 b.金属钠 c.饱和NaHCO3溶液
⑵自从四苯乙烯(TPE)的聚集诱导发光(AIE)现象被报道以来,这一与常规荧光分子聚集诱导荧光淬灭(ACQ)性质截然不同的特性引起了科研工作者的广泛兴趣。以下是TFE的一种合成路线(部分试剂及反应条件省略):

① A的名称是_____ ;B中官能团的名称是_____ ,D中官能团的名称是_____ ;
② B→C的反应类型为_____ ; E→F的化学方程式是_____ 。
③ W是D的同分异构体,具有下列结构特征:ⅰ.属于萘( )的一元取代物;ⅱ.存在羟甲基(-CH2OH)。写出W的一种可能的结构简式:
)的一元取代物;ⅱ.存在羟甲基(-CH2OH)。写出W的一种可能的结构简式:_____ 。
化学科学与材料、人体健康和环境保护等密切相关。
(1)践行“绿水青山就是金山银山”理念,实现人与自然和谐共生。
①下列做法会加剧雾霾天气的是
a.禁烧秸秆 b.潮汐发电 c.燃煤供暖
②下列污水处理的方法中只涉及物理方法的是
a.活性炭吸附法 b.氧化还原法 c.中和法
③下列措施
a.封闭式焚烧 b.露天堆放 c.卫生填埋
④处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,发生反应的化学方程式为
(2)营养均衡、合理用药是人体健康的保证。
现代医学研究表明,甘蔗中含有丰富的糖分、水分,此外,还含有对人体新陈代谢非常有益的各种维生素、脂肪、蛋白质、有机酸(苹果酸、柠檬酸)、氨基酸、钙、铁、磷、钾、铜、锌、镁、硒等物质。
①钙、锌、磷、钾元素中属于人体所需微量元素的是
②人体需要的营养素主要有糖类、油脂、蛋白质、无机盐、维生素和
③
a.维生素A b.维生素C c.维生素D
④甘蔗中所含丝氨酸、赖氨酸为人体自身不能合成,该类氨基酸被称为
⑤苹果酸、柠檬酸属于
a.酸味剂 b.甜味剂 c.着色剂
⑥以下药物可以治疗胃酸分泌过多的是
a.阿司匹林 b.泡腾片 c.复方氢氧化铝片
(3)创新发展材料推动人类社会的进步。2019年1月3日10时26分,由中国航天科技集团有限公司研制的嫦娥四号探测器成功着陆在月球背面预选着陆区。

①嫦娥四号探测器采用大量CFRP(碳纤维增强塑料)。CFRP属于
a.金属材料 b.无机非金属材料 c.复合材料
②嫦娥四号探测器的承力梁采用轻质钛合金构件。下列
a.高强度 b.高密度 c.高韧性
③嫦娥四号探测器的飞行仪表板多采用有机玻璃材料。有机玻璃受热易熔化,易于加工成型,属于
④机场建设需要大量的钢材、水泥、玻璃等建筑材料,其中生产水泥和玻璃所需的共同原料是
B.有机化学基础
⑴ 根据分子中所含官能团可预测有机化合物的性质。
① 分子中所有原子位于同一条直线上的是
a.乙烷 b.乙烯 c.乙炔
② 能发生水解反应的有机物是
a.CH3CH2Br b.CH3CH2OH c.葡萄糖
③ 鉴别苯与甲苯适宜的试剂是
a.水 b.KMnO4酸性溶液 c.NaOH溶液
④ 下列化合物中,能发生酯化反应的是
a.CH3CHO b.HCOOCH3 c.CH3OH
⑤ 能鉴别
 和
和 两种物质的试剂是
两种物质的试剂是a.FeCl3溶液 b.金属钠 c.饱和NaHCO3溶液
⑵自从四苯乙烯(TPE)的聚集诱导发光(AIE)现象被报道以来,这一与常规荧光分子聚集诱导荧光淬灭(ACQ)性质截然不同的特性引起了科研工作者的广泛兴趣。以下是TFE的一种合成路线(部分试剂及反应条件省略):

① A的名称是
② B→C的反应类型为
③ W是D的同分异构体,具有下列结构特征:ⅰ.属于萘(
 )的一元取代物;ⅱ.存在羟甲基(-CH2OH)。写出W的一种可能的结构简式:
)的一元取代物;ⅱ.存在羟甲基(-CH2OH)。写出W的一种可能的结构简式:
您最近一年使用:0次
名校
10 . 如图是氯的价类二维图:
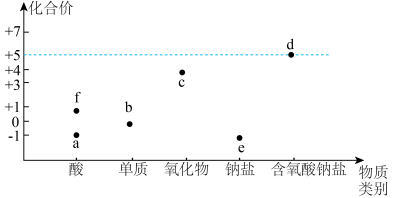
其中c是一种新型净水剂,其合成路线如图:
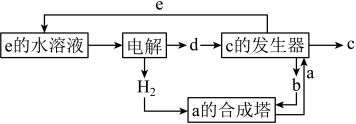
(1)c为___________ (填化学式)。
(2)“a时合成塔”中发生反应的化学方程式为___________ 。
(3)“c的发生器”中发生反应的离子方程式为___________ (写出正确的离子方程式并用单线桥 法分析电子转移的情况)。
(4)实验测得等物质的量的f、 、
、 具有相同的漂白能力,原因是
具有相同的漂白能力,原因是___________ 。
(5)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如: 的氧化半反应可以表示为:
的氧化半反应可以表示为: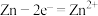 ,电解时生成d的氧化半反应式为
,电解时生成d的氧化半反应式为___________ 。
(6)为测定新型净水剂溶液中c的浓度(加入某种物质使c在溶液中稳定存在),量取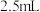 该溶液于锥形瓶中,加蒸馏水稀释到
该溶液于锥形瓶中,加蒸馏水稀释到 ,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应:
,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应: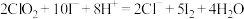 )。然后用
)。然后用 硫代硫酸钠溶液还原产生的
硫代硫酸钠溶液还原产生的 (发生反应:
(发生反应: ),完全反应时消耗的硫代硫酸钠的体积
),完全反应时消耗的硫代硫酸钠的体积 ,计算此新型净水剂中c的物质的量浓度为
,计算此新型净水剂中c的物质的量浓度为___________ 。

其中c是一种新型净水剂,其合成路线如图:

(1)c为
(2)“a时合成塔”中发生反应的化学方程式为
(3)“c的发生器”中发生反应的离子方程式为
(4)实验测得等物质的量的f、
 、
、 具有相同的漂白能力,原因是
具有相同的漂白能力,原因是(5)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:
 的氧化半反应可以表示为:
的氧化半反应可以表示为: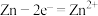 ,电解时生成d的氧化半反应式为
,电解时生成d的氧化半反应式为(6)为测定新型净水剂溶液中c的浓度(加入某种物质使c在溶液中稳定存在),量取
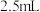 该溶液于锥形瓶中,加蒸馏水稀释到
该溶液于锥形瓶中,加蒸馏水稀释到 ,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应:
,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应: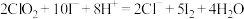 )。然后用
)。然后用 硫代硫酸钠溶液还原产生的
硫代硫酸钠溶液还原产生的 (发生反应:
(发生反应: ),完全反应时消耗的硫代硫酸钠的体积
),完全反应时消耗的硫代硫酸钠的体积 ,计算此新型净水剂中c的物质的量浓度为
,计算此新型净水剂中c的物质的量浓度为
您最近一年使用:0次
2024-02-20更新
|
99次组卷
|
2卷引用:吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题



