1 . 化合物M是一种新型发光材料中间体。实验室由烃A制备M的一种合成路线如下:
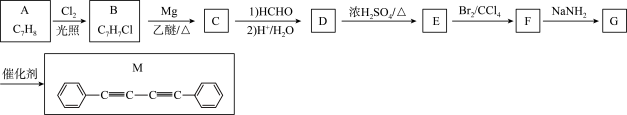
已知:①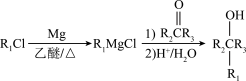
②2RC≡CH RC≡C-C≡CR(R、R1、R2、R3表示氢原子或烃基)
RC≡C-C≡CR(R、R1、R2、R3表示氢原子或烃基)
回答下列问题:
(1)由A生成B的反应类型为___________ 。
(2)C的结构简式为___________ 。D中官能团的电子式为___________
(3)E的化学名称为___________ ;由E制得高聚物的平均相对分子质量为10400,则所得高聚物的平均聚合度为___________ 。
(4)由G生成M的化学方程式为___________ 。
(5)参照上述合成路线和信息,以1,2-二氯乙烷为原料(其他无机试剂任选),设计制备丁烷的合成路线___________ 。

已知:①

②2RC≡CH
 RC≡C-C≡CR(R、R1、R2、R3表示氢原子或烃基)
RC≡C-C≡CR(R、R1、R2、R3表示氢原子或烃基)回答下列问题:
(1)由A生成B的反应类型为
(2)C的结构简式为
(3)E的化学名称为
(4)由G生成M的化学方程式为
(5)参照上述合成路线和信息,以1,2-二氯乙烷为原料(其他无机试剂任选),设计制备丁烷的合成路线
您最近半年使用:0次
解题方法
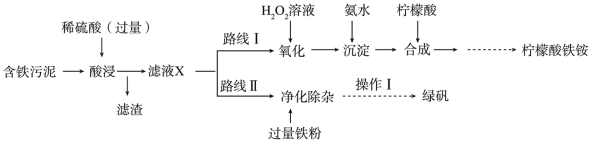
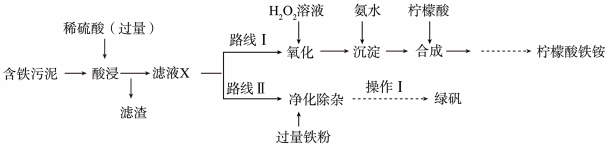
2 . 某实验小组以含铁污泥(主要成分为 、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(
、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾( )和柠檬酸铁铵。
)和柠檬酸铁铵。
根据所学知识,回答下列问题:
(1)写出“酸浸”时, 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:_______ 。
(2)“滤液X”中一定含有的阳离子为_______ 。
(3)路线Ⅰ中,加入 溶液的目的是
溶液的目的是_______ 。
(4)写出加入过量铁粉时发生反应的离子方程式:_______ 。
(5)“操作Ⅰ”为过滤、_______ 、_______ 、过滤、洗涤、低温烘干。
(6)“酸浸”时加入400mL1.5 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为_______ g。
 、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(
、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾( )和柠檬酸铁铵。
)和柠檬酸铁铵。
根据所学知识,回答下列问题:
(1)写出“酸浸”时,
 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:(2)“滤液X”中一定含有的阳离子为
(3)路线Ⅰ中,加入
 溶液的目的是
溶液的目的是(4)写出加入过量铁粉时发生反应的离子方程式:
(5)“操作Ⅰ”为过滤、
(6)“酸浸”时加入400mL1.5
 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
您最近半年使用:0次
解题方法
3 . 某实验小组以含铁污泥(主要成分为 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
(1)写出“酸浸”时, 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:___________ 。
(2)“滤液X”中含有的阳离子为___________ 。
(3)路线I中,加入 溶液的目的是
溶液的目的是___________ 。
(4)写出加入氨水“沉淀”时的离子方程式:___________ 。
(5)写出加入过量铁粉时发生反应的离子方程式:___________ 、___________ 。
(6)“酸浸”时加入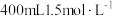 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为___________ g。
 、
、 及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾
及其他杂质;杂质与酸不反应,且难溶于水)为原料,设计了如下两种不同的合成路线(部分步骤已略去),用于生产绿矾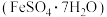 和柠檬酸铁铵。
和柠檬酸铁铵。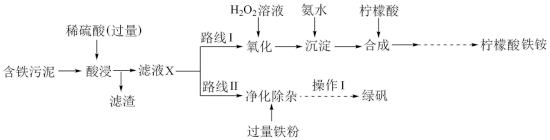
(1)写出“酸浸”时,
 与硫酸反应的离子方程式:
与硫酸反应的离子方程式:(2)“滤液X”中含有的阳离子为
(3)路线I中,加入
 溶液的目的是
溶液的目的是(4)写出加入氨水“沉淀”时的离子方程式:
(5)写出加入过量铁粉时发生反应的离子方程式:
(6)“酸浸”时加入
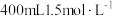 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得的绿矾的质量为
您最近半年使用:0次
名校
解题方法
4 . 铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠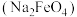 是水处理过程中的一种新型净水剂,工业上利用
是水处理过程中的一种新型净水剂,工业上利用 和
和 的混合溶液将
的混合溶液将 氧化性制备高铁酸钠,反应的化学方程式为
氧化性制备高铁酸钠,反应的化学方程式为______ ;高铁酸钠能用作新型净水剂的原理是______ 。
(2)某实验小组模拟工业制法,以含铁污泥(主要成分为 、
、 、
、 及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
根据所学知识,回答下列问题:
①“滤液X”中一定含有的阳离子为______ 。
②路线I中,加入 溶液的离子方程式
溶液的离子方程式______ 。
③“操作I”为过滤、______ 、______ 、过滤、洗涤、低温烘干。
④实验室用绿矾配置硫酸亚铁溶液时,往往会加入适量的稀硫酸,请你解释其中原因______ (结合必要的方程式)。
(1)高铁酸钠
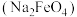 是水处理过程中的一种新型净水剂,工业上利用
是水处理过程中的一种新型净水剂,工业上利用 和
和 的混合溶液将
的混合溶液将 氧化性制备高铁酸钠,反应的化学方程式为
氧化性制备高铁酸钠,反应的化学方程式为(2)某实验小组模拟工业制法,以含铁污泥(主要成分为
 、
、 、
、 及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾
及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾 和柠檬酸铁铵。
和柠檬酸铁铵。
根据所学知识,回答下列问题:
①“滤液X”中一定含有的阳离子为
②路线I中,加入
 溶液的离子方程式
溶液的离子方程式③“操作I”为过滤、
④实验室用绿矾配置硫酸亚铁溶液时,往往会加入适量的稀硫酸,请你解释其中原因
您最近半年使用:0次
名校
解题方法
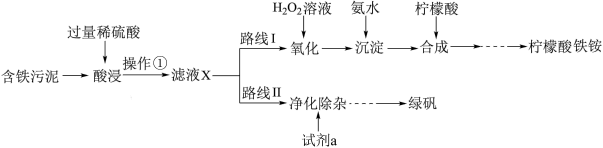
5 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。

根据所学知识,回答下列问题:
(1)“滤液X”中一定含有的阳离子为___________ 。
(2)路线Ⅰ中,加入H2O2溶液的目的是___________ (用离子方程式表示)。
(3)加入过量试剂a时发生反应的离子方程式___________ 。
(4)“操作②”为过滤、___________ 、___________ 过滤、洗涤、干燥。
(5)“酸浸”时加入400mL 1.5mol/L 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得绿矾得质量为___________ g。

根据所学知识,回答下列问题:
(1)“滤液X”中一定含有的阳离子为
(2)路线Ⅰ中,加入H2O2溶液的目的是
(3)加入过量试剂a时发生反应的离子方程式
(4)“操作②”为过滤、
(5)“酸浸”时加入400mL 1.5mol/L 硫酸(硫酸过量),若仅按照路线Ⅱ发生反应,则理论上制得绿矾得质量为
您最近半年使用:0次
解题方法
6 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。
根据所学知识,回答下列问题:
(1)操作①的名称是_______ ,路线I中,加入H2O2溶液的目的是_______ 。
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:_______ ;检验含有Fe3+的试剂是_______ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是_______ 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
(5)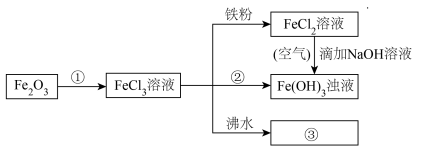
FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是_______ 。

根据所学知识,回答下列问题:
(1)操作①的名称是
(2)写出“酸浸”时,Fe2O3与硫酸反应的化学方程式:
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
(5)

FeCl2溶液→Fe(OH)3浊液的过程中,观察到的实验现象是
您最近半年使用:0次
名校
7 . 化合物I是合成米非司酮的一种中间体,其合成路线如下:

已知:①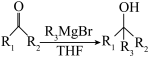 (R1、R2为烃基或H,R3为烃基)
(R1、R2为烃基或H,R3为烃基)
②C、D、F均为含有-CN(氰基)的腈类化合物,如CH2CN可称为乙腈。
回答下列问题:
(1)A的化学名称为_________ 。
(2)由A生成C的反应类型是______ 。
(3)由D和E生成F的化学方程式为_______ 。
(4)H的结构简式为________ 。
(5)I中所含官能团的名称为_______ 。
(6)G的芳香同分异构体中,含有酯基且能发生银镜反应,核磁共振氢谱有4组峰,且峰面积之比为9:2:2:1的有_______ 种。
(7)设计以CH2=CHCH2Cl和 为原料制备
为原料制备 的合成路线
的合成路线________ (无机试剂及有机溶剂任用)。

已知:①
 (R1、R2为烃基或H,R3为烃基)
(R1、R2为烃基或H,R3为烃基)②C、D、F均为含有-CN(氰基)的腈类化合物,如CH2CN可称为乙腈。
回答下列问题:
(1)A的化学名称为
(2)由A生成C的反应类型是
(3)由D和E生成F的化学方程式为
(4)H的结构简式为
(5)I中所含官能团的名称为
(6)G的芳香同分异构体中,含有酯基且能发生银镜反应,核磁共振氢谱有4组峰,且峰面积之比为9:2:2:1的有
(7)设计以CH2=CHCH2Cl和
 为原料制备
为原料制备 的合成路线
的合成路线
您最近半年使用:0次
2020-09-09更新
|
180次组卷
|
2卷引用:湖南省百校联考2021届高三8月联考化学试题
名校
解题方法
8 . 按要求回答下列问题:
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:__________________________________________ ;若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将__________ (填“增加”、“减少”或“不变”)。
(2)已知 的电离平衡常数
的电离平衡常数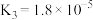 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至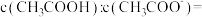 1:18,此时溶液PH=
1:18,此时溶液PH=________ 。
(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
则该反应的热化学反应方程式为:___________________________ 。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_________________________________ 。

(4)已知2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________ 。
③达到平衡后CH3OH的浓度为_____________ 。
(5)制取聚乙二酸乙二酯的反应方程式_______________________________
(6)有一种耐热型树脂材料的结构简式为 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________ 。
(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为_________ 。
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。
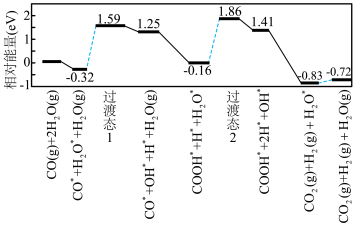
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:_________________________
(10)已知: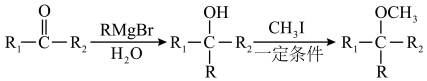 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以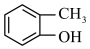 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________ 。
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:
(2)已知
 的电离平衡常数
的电离平衡常数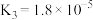 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至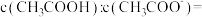 1:18,此时溶液PH=
1:18,此时溶液PH=(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是

(4)已知2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.4 | 0.1 | 0.1 |
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为
③达到平衡后CH3OH的浓度为
(5)制取聚乙二酸乙二酯的反应方程式
(6)有一种耐热型树脂材料的结构简式为
 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。

可知水煤气变换的ΔH
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:
(10)已知:
 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)
您最近半年使用:0次
名校
9 . 有机工业制备的重要的中间体F的合成工艺流程如图:
(1)X的结构简式为______ 。E的结构简式为______ 。
(2)下列说法正确的是______ 。
(3)根据题中信息,写出Y在NaOH溶液中反应化学反应方程式______ 。
(4)写出所有符合下列条件的化合物C的同分异构体:______ 。
①结构中含有苯环,无其他环状结构;苯环上的一元取代物只有一种
②IR光谱显示结构中含“-CN”和“C=S”结构;
③1H-NMR谱显示结构中有3种化学环境的氢原子,个数比为1:6:6。
(5)请以化合物CH2=CH2、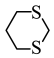 为原料,设计化合物
为原料,设计化合物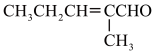 的合成路线:
的合成路线:______ (无机试剂任选)。
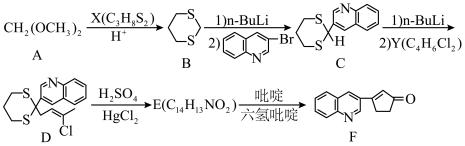
已知:R1COR2+RCH2COR′
(1)X的结构简式为
(2)下列说法正确的是
| A.-SH的性质类似于-OH,化合物X一定条件下可发生缩聚反应 |
| B.化合物C中有一个手性C原子,所有原子可以在同一平面上 |
| C.化合物F可发生还原反应、加聚反应、水解反应 |
D.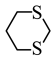 的结构中,4个C和2个S的杂化方式均相同 的结构中,4个C和2个S的杂化方式均相同 |
(4)写出所有符合下列条件的化合物C的同分异构体:
①结构中含有苯环,无其他环状结构;苯环上的一元取代物只有一种
②IR光谱显示结构中含“-CN”和“C=S”结构;
③1H-NMR谱显示结构中有3种化学环境的氢原子,个数比为1:6:6。
(5)请以化合物CH2=CH2、
 为原料,设计化合物
为原料,设计化合物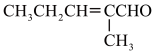 的合成路线:
的合成路线:
您最近半年使用:0次
2023-01-02更新
|
1636次组卷
|
5卷引用:浙江省杭州学军中学2022-2023学年高三上学期模拟考试化学试题
名校
10 . I.过渡元素性质复杂多样,请根据下列描述回答问题。
(1)Cu元素在周期表中位于____ 区,它可与多种有机物形成配合物。CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),配位数为4,请在框内画出其结构示意图并用“→”表示出其中的配位键____ 。

(2)有机物E与铜(II)的配合物是一种可发光的发光材料,在发光器材方面有很好的应用前景。其合成E的路线如图,回答下列问题:
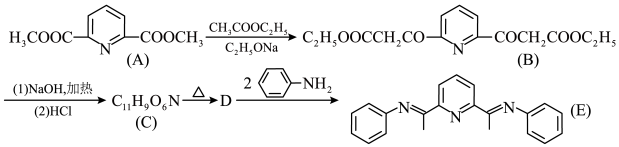
①C生成D的过程中有一种温室气体生成,写出D生成E的化学方程式____ 。
②A有多种同分异构体,其中符合以下条件的共有____ 种。
i.分子中含有吡啶环( )且环上只有2个取代基;
)且环上只有2个取代基;
ii.只含有一种官能团,且核磁共振氢谱只有四种峰;
iii.吡啶环上的一氯取代物只有2种
③结合题给信息,以 和
和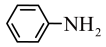 为原料合成西佛碱N-苯基苯甲亚胺
为原料合成西佛碱N-苯基苯甲亚胺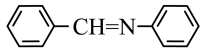 请在框内写出合成路线
请在框内写出合成路线____ 。

II.实验小组对NaHSO3溶液与可溶性铜盐溶液的反应进行探究。
已知:i.Cu2+ [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
ii.Cu+ [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(3)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到____ ,反应的离子方程式为_____ 。
(4)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是____ 。
②实验表明假设b合理,实验I反应的离子方程式有_____ 、H++HSO =SO2↑+H2O
=SO2↑+H2O
(5)对比实验I、II,提出假设c:Cl-增强了Cu2+的氧化性。
下述实验III证实了假设c合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_____ (补全实验操作及现象)。

(6)将实验II的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO 。
。
①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV: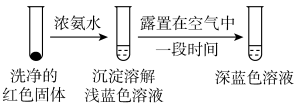
证实红色沉淀中含有Cu+的实验证据是:____ 。
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验V,证实了Cu2+的存在。实验V的方案和现象是:____ 。
(1)Cu元素在周期表中位于

(2)有机物E与铜(II)的配合物是一种可发光的发光材料,在发光器材方面有很好的应用前景。其合成E的路线如图,回答下列问题:

①C生成D的过程中有一种温室气体生成,写出D生成E的化学方程式
②A有多种同分异构体,其中符合以下条件的共有
i.分子中含有吡啶环(
 )且环上只有2个取代基;
)且环上只有2个取代基;ii.只含有一种官能团,且核磁共振氢谱只有四种峰;
iii.吡啶环上的一氯取代物只有2种
③结合题给信息,以
 和
和 为原料合成西佛碱N-苯基苯甲亚胺
为原料合成西佛碱N-苯基苯甲亚胺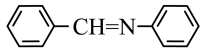 请在框内写出合成路线
请在框内写出合成路线
II.实验小组对NaHSO3溶液与可溶性铜盐溶液的反应进行探究。
| 实验 | 装置 | 试剂x | 操作及现象 |
| I |  | 1mol·L−1CuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| II | 1mol·L−1CuSO4溶液 | 加入2mLCuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)ii.Cu+
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(3)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到
(4)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
 =SO2↑+H2O
=SO2↑+H2O(5)对比实验I、II,提出假设c:Cl-增强了Cu2+的氧化性。
下述实验III证实了假设c合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管

(6)将实验II的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO
 。
。①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:

证实红色沉淀中含有Cu+的实验证据是:
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验V,证实了Cu2+的存在。实验V的方案和现象是:
您最近半年使用:0次



