名校
解题方法
1 . 碳酸锰(MnCO3)是制造电信器材软磁铁氧体、合成MnO2和制造其他锰盐的原料。实验室以KMnO4为原料制备少量MnCO3并研究其性质,制备MnCO3的装置如图所示。

已知:MnCO3溶于稀酸、难溶于乙醇,100℃开始分解。请回答下列问题:
(1)仪器A的名称为___________ 。
(2)在烧瓶中加入一定的KMnO4粉末,滴加硫酸酸化的H2C2O4溶液,该反应中若有1mol氧化剂被还原,则生成的氧化产物的物质的量为___________ ;反应过程中c(Mn2+)随时间的变化曲线如图所示,则tmin时,c(Mn2+)迅速增大的原因是___________ 。

(3)反应一段时间后,当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3.生成MnCO3的离子方程式为___________ 。
(4)实验结束后,将装置A中的混合物过滤,用___________ 洗涤滤渣,再___________ (填“低温”或“高温”)烘干,即得到干燥的MnCO3固体。
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质盘变化如图所示。则A→B反应的化学方程式为___________ ,C点的成分为___________ (填化学式)。


已知:MnCO3溶于稀酸、难溶于乙醇,100℃开始分解。请回答下列问题:
(1)仪器A的名称为
(2)在烧瓶中加入一定的KMnO4粉末,滴加硫酸酸化的H2C2O4溶液,该反应中若有1mol氧化剂被还原,则生成的氧化产物的物质的量为

(3)反应一段时间后,当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3.生成MnCO3的离子方程式为
(4)实验结束后,将装置A中的混合物过滤,用
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质盘变化如图所示。则A→B反应的化学方程式为

您最近一年使用:0次
2 . 钯(Pd)是重要的金属元素,在有机合成工业上用途广泛。自然界中,钯含量少,常伴生在其他矿藏中,如硫化镍铜矿、镍黄铁矿等。以硫化镍铜矿(含有CuS、NiS、 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:

已知“酸浸”后的固体剩余物为 、PdO(不与碱反应)。回答下列问题:
、PdO(不与碱反应)。回答下列问题:
(1)“灼烧”时产生的污染性气体是_______ (填化学式)。
(2)写出“除硅”反应的离子方程式:_______ 。
(3)“系列操作”包括_______ 、过滤、洗涤、干燥。
(4)“还原”时反应还生成无污染的气体,化学方程式为_______ 。
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:_______ 。
(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:
已知“酸浸”后的固体剩余物为
 、PdO(不与碱反应)。回答下列问题:
、PdO(不与碱反应)。回答下列问题:(1)“灼烧”时产生的污染性气体是
(2)写出“除硅”反应的离子方程式:
(3)“系列操作”包括
(4)“还原”时反应还生成无污染的气体,化学方程式为
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有
 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
3 . 铝土矿是生产金属铝的最佳原料,也是最主要的应用领域,其用量占世界铝土矿总产量的 以上。以铝土矿(主要成分为
以上。以铝土矿(主要成分为 ,含有
,含有 和
和 等杂质)为原料,制备有机合成中的重要还原剂铝氢化钠
等杂质)为原料,制备有机合成中的重要还原剂铝氢化钠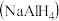 的一种工业流程如图:
的一种工业流程如图:

已知: 、
、 、
、 遇水都能迅速发生反应。
遇水都能迅速发生反应。
(1)写出碱溶时发生反应的离子方程式:_______ 、_______ 。
(2)滤渣I中的主要成分为_______ (写物质名称)。
(3) 与水反应的氧化剂和还原剂的物质的量之比为
与水反应的氧化剂和还原剂的物质的量之比为_______ 。
(4)写出反应I中主要反应的化学方程式:_______ 。
 以上。以铝土矿(主要成分为
以上。以铝土矿(主要成分为 ,含有
,含有 和
和 等杂质)为原料,制备有机合成中的重要还原剂铝氢化钠
等杂质)为原料,制备有机合成中的重要还原剂铝氢化钠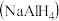 的一种工业流程如图:
的一种工业流程如图:
已知:
 、
、 、
、 遇水都能迅速发生反应。
遇水都能迅速发生反应。(1)写出碱溶时发生反应的离子方程式:
(2)滤渣I中的主要成分为
(3)
 与水反应的氧化剂和还原剂的物质的量之比为
与水反应的氧化剂和还原剂的物质的量之比为(4)写出反应I中主要反应的化学方程式:
您最近一年使用:0次
解题方法
4 . 氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为_______ 。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到_______ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□ +□_____。
+□_____。_______ ,该反应完毕的现象标志是_______ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是_______ 。
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
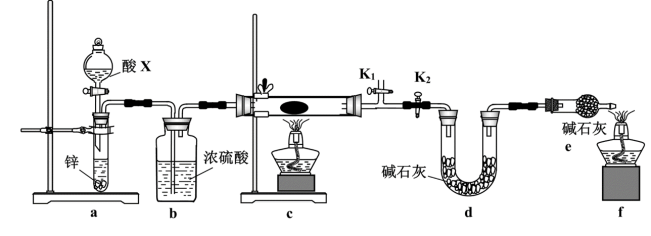
①装置a中所加的酸X是_______ (填化学式)。
②通过测定下列物理量,能达到实验目的的是_______ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是_______ 。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□
 +□_____。
+□_____。(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是
您最近一年使用:0次
5 . 甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是___________ (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断反应I为______________ 热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为__________ ,此时的温度为___________ (从表中选择)。
(2) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH=____________ kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O )时,实验室利用下图装置模拟该法:
)时,实验室利用下图装置模拟该法:

①N电极的电极反应式为____________ 。
② 请完成电解池中Cr2O 转化为Cr3+的离子反应方程式:
转化为Cr3+的离子反应方程式:____________
Cr2O + Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH=____________ 。(已知, Ksp[Cr(OH)3]=6.4×10‾31,lg2=0.3)
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应II:CO2(g)+3H2(g)
 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2① 上述反应符合“原子经济”原则的是
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为
(2) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH=
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O
 )时,实验室利用下图装置模拟该法:
)时,实验室利用下图装置模拟该法:
①N电极的电极反应式为
② 请完成电解池中Cr2O
 转化为Cr3+的离子反应方程式:
转化为Cr3+的离子反应方程式:Cr2O
 + Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ](4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH=
您最近一年使用:0次



