1 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制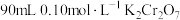 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还有________ 。
②计算,称量:需用托盘天平称量________ g  固体[
固体[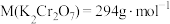 ]。
]。
③溶解,恢复到室温、转移、洗涤、定容。
④下列操作使结果偏高 的是________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线
D.未用蒸馏水洗涤烧杯和玻璃棒
E.溶液未恢复至室温即转移
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以 和
和 的形式存在)
的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ (用离子方程式)。
②请配平步骤②中发生反应的离子反应方程式:_______________
____ ______
______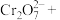 ______
______ _____
_____ _____
_____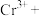 _____
_____ 。
。
③某同学3次测定所消耗的 溶液的体积如下:
溶液的体积如下:
消耗 溶液的平均体积是
溶液的平均体积是___________ mL。
④实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
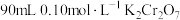 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还有
②计算,称量:需用托盘天平称量
 固体[
固体[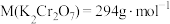 ]。
]。③溶解,恢复到室温、转移、洗涤、定容。
④下列操作使结果
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线
D.未用蒸馏水洗涤烧杯和玻璃棒
E.溶液未恢复至室温即转移
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以
 和
和 的形式存在)
的形式存在)| 步骤一 | 取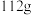 黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入 酸性 酸性 溶液,恰好完全反应 溶液,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
____
 ______
______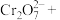 ______
______ _____
_____ _____
_____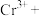 _____
_____ 。
。③某同学3次测定所消耗的
 溶液的体积如下:
溶液的体积如下:| 测定次数 | 第1次 | 第2次 | 第3次 |
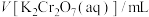 | 10.00 | 9.98 | 10.02 |
 溶液的平均体积是
溶液的平均体积是④实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
解题方法
2 . 七水合硫酸亚铁 在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为
在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为 、含少量
、含少量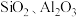 等杂质)制备
等杂质)制备 的一种流程如下:
的一种流程如下:

已知:
(1)“滤渣Ⅰ”的主要成分是___________ (填名称);“酸浸”前粉碎硫铁矿烧渣的目的是___________ 。
(2)“滤液Ⅰ”加入过量的 溶液,发生反应的离子方程式有
溶液,发生反应的离子方程式有___________ 、___________ 和___________ ,检验 离子沉淀完全的实验操作是
离子沉淀完全的实验操作是___________ 。
(3)“滤液Ⅱ”中主要的阴离子有___________ (填离子符号)。
(4)为得到纯净的产物,加入“试剂Ⅰ”是___________ (填序号,下同),“试剂Ⅱ”是___________ 。
① ②
② ③
③ ④
④
⑤ ⑥
⑥
(5)“滤液Ⅲ”经___________ 、___________ 、过滤、洗涤,得到 晶体。
晶体。
(6)某同学用酸性 测定某补血剂
测定某补血剂 中铁的含量:取
中铁的含量:取 补血药片,加硫酸酸化后,滴加
补血药片,加硫酸酸化后,滴加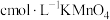 溶液
溶液 恰好完全反应(假定药片中其他成分与
恰好完全反应(假定药片中其他成分与 不反应),则该补血剂中铁元素的质量分数为
不反应),则该补血剂中铁元素的质量分数为___________  。
。
 在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为
在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为 、含少量
、含少量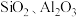 等杂质)制备
等杂质)制备 的一种流程如下:
的一种流程如下:
已知:

(1)“滤渣Ⅰ”的主要成分是
(2)“滤液Ⅰ”加入过量的
 溶液,发生反应的离子方程式有
溶液,发生反应的离子方程式有 离子沉淀完全的实验操作是
离子沉淀完全的实验操作是(3)“滤液Ⅱ”中主要的阴离子有
(4)为得到纯净的产物,加入“试剂Ⅰ”是
①
 ②
② ③
③ ④
④
⑤
 ⑥
⑥
(5)“滤液Ⅲ”经
 晶体。
晶体。(6)某同学用酸性
 测定某补血剂
测定某补血剂 中铁的含量:取
中铁的含量:取 补血药片,加硫酸酸化后,滴加
补血药片,加硫酸酸化后,滴加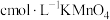 溶液
溶液 恰好完全反应(假定药片中其他成分与
恰好完全反应(假定药片中其他成分与 不反应),则该补血剂中铁元素的质量分数为
不反应),则该补血剂中铁元素的质量分数为 。
。
您最近一年使用:0次
3 . 氧钒(IV)碱式碳酸铵晶体难溶于水,是制备热敏材料 的原料,其化学式为
的原料,其化学式为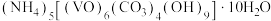 。实验室以
。实验室以 和
和 为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知
为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知 价钒的化合物易被氧化。回答下列问题:
价钒的化合物易被氧化。回答下列问题:
(1)盛装 溶液的仪器的名称为
溶液的仪器的名称为___________ 。
(2)实验步骤I:检查装置气密性,开始实验,先___________ (填实验操作),当D中溶液变浑浊,关闭 ,进行上述实验操作的目的是
,进行上述实验操作的目的是___________ 。
实验步骤II:打开 ,滴入
,滴入 溶液,开始反应。
溶液,开始反应。
(3)装置B中饱和 溶液的作用是
溶液的作用是___________ 。
(4) 溶液可由
溶液可由 经过还原制备,该还原过程需要加入稀盐酸和
经过还原制备,该还原过程需要加入稀盐酸和 ,且其他产物均为绿色环保物质,写出该反应的化学方程式:
,且其他产物均为绿色环保物质,写出该反应的化学方程式:___________ 。
(5)测定粗产品[氧钒(IV)碱式碳酸铵晶体]中钒的含量。实验步骤如下:称量m g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入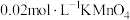 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用 标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知:
标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知: )
)
① 溶液的作用是
溶液的作用是___________ 。
②粗产品中钒的质量分数表达式为___________ (以 计)。
计)。
③若滴定前俯视读数,终点时仰视读数,则测定结果___________ (填“偏高”“偏低”或“无影响”)。
 的原料,其化学式为
的原料,其化学式为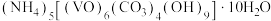 。实验室以
。实验室以 和
和 为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知
为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。已知 价钒的化合物易被氧化。回答下列问题:
价钒的化合物易被氧化。回答下列问题:
(1)盛装
 溶液的仪器的名称为
溶液的仪器的名称为(2)实验步骤I:检查装置气密性,开始实验,先
 ,进行上述实验操作的目的是
,进行上述实验操作的目的是实验步骤II:打开
 ,滴入
,滴入 溶液,开始反应。
溶液,开始反应。(3)装置B中饱和
 溶液的作用是
溶液的作用是(4)
 溶液可由
溶液可由 经过还原制备,该还原过程需要加入稀盐酸和
经过还原制备,该还原过程需要加入稀盐酸和 ,且其他产物均为绿色环保物质,写出该反应的化学方程式:
,且其他产物均为绿色环保物质,写出该反应的化学方程式:(5)测定粗产品[氧钒(IV)碱式碳酸铵晶体]中钒的含量。实验步骤如下:称量m g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入
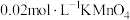 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用 标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知:
标准溶液滴定至终点,消耗标准溶液的体积为VmL。(已知: )
)①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数表达式为
 计)。
计)。③若滴定前俯视读数,终点时仰视读数,则测定结果
您最近一年使用:0次
解题方法
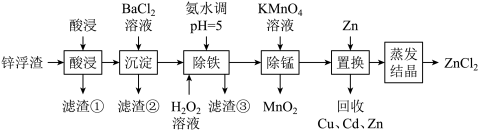
4 . 利用冶炼、电池生产等工业中产生的废锌浮渣(主要含Zn和ZnO,还含有少量FeO、MnO、CuO、CdO等氧化物或硫酸盐及少量SiO2等)。采用如下工艺流程回收其中的锌制备氯化锌:
回答下列问题:
(1)“酸浸”中盐酸与ZnO反应的化学方程式_______ 。
(2)“沉淀”除去的离子是_______ 。
(3)“除铁”时先后加入了两种试剂,应先加入_______ ,再加入_______ ,原因是_______ 。
(4)“除锰”时的离子方程式为_______ 。
(5)制得的ZnCl2成品中可能含有的杂质为Zn(OH)Cl,已知浓缩液的蒸发温度与碱式盐的含量如图所示。
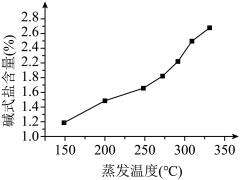
①降低成品中的碱式盐含量的方法有_______ 。
②采用中和滴定法测定该样品的组成,实验步骤如下:取10.0000g样品于锥形瓶中,加入50ml.蒸馏水溶解,用甲基橙做指示剂,用0.1000 mol/L的盐酸滴定至溶液由黄色变为浅红色且30s内不恢复成原色,消耗盐酸的体积为20.00mL。样品中所含Zn(OH)Cl(M=117.5g/mol)杂质的质量分数为_______ 。

回答下列问题:
(1)“酸浸”中盐酸与ZnO反应的化学方程式
(2)“沉淀”除去的离子是
(3)“除铁”时先后加入了两种试剂,应先加入
(4)“除锰”时的离子方程式为
(5)制得的ZnCl2成品中可能含有的杂质为Zn(OH)Cl,已知浓缩液的蒸发温度与碱式盐的含量如图所示。

①降低成品中的碱式盐含量的方法有
②采用中和滴定法测定该样品的组成,实验步骤如下:取10.0000g样品于锥形瓶中,加入50ml.蒸馏水溶解,用甲基橙做指示剂,用0.1000 mol/L的盐酸滴定至溶液由黄色变为浅红色且30s内不恢复成原色,消耗盐酸的体积为20.00mL。样品中所含Zn(OH)Cl(M=117.5g/mol)杂质的质量分数为
您最近一年使用:0次
2021-01-14更新
|
861次组卷
|
4卷引用:贵州省贵阳市五校2021-2022学年高三年级上学期联合考试(三)理科综合化学试题
贵州省贵阳市五校2021-2022学年高三年级上学期联合考试(三)理科综合化学试题四川省资阳、眉山、遂宁、广安、自贡、广元等六市2021届第一次诊断性考试理综化学试题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)学科网2020年高三1月大联考考后强化卷(山东卷)
解题方法
5 . 过滤在实验、生产、生活中有着广泛的应用。某研究性学习小组在实验室测定某含NaCl杂质的碳酸钠样品中Cl-的含量,其实验步骤如下:
①将100g样品溶于水得到溶液A;
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来;
③经过滤,得到固体C,洗涤,干燥;
④称量得固体C的质量
(1)沉淀剂B为___________ (填化学式)。
(2)向A中加入稀HNO3酸化的目的是___________ 。
(3)如何洗涤固体C:___________ 。
(4)如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数___________ (填“偏大”“偏小”或“不变”)。
①将100g样品溶于水得到溶液A;
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来;
③经过滤,得到固体C,洗涤,干燥;
④称量得固体C的质量
(1)沉淀剂B为
(2)向A中加入稀HNO3酸化的目的是
(3)如何洗涤固体C:
(4)如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数
您最近一年使用:0次
名校
解题方法
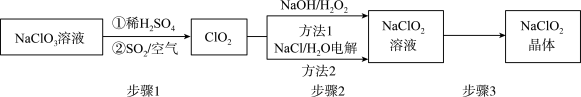
6 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是___ ,通入空气的作用是____ 。
(2)方法1中,反应的离子方程式是___ ,利用方法1制NaClO2时,温度不能超过20℃,可能的原因是____ 。
(3)方法2中,NaClO2在___ 生成(选填“阴极”或“阳极”)。
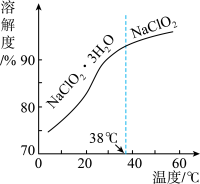
(4)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是__ 。
(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO +4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为____ 。(用含a、b、c的代数式表示)。

已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是
(2)方法1中,反应的离子方程式是
(3)方法2中,NaClO2在
(4)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是

(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。②移取25.00mL待测溶液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为
您最近一年使用:0次
7 . Ⅰ.(1)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算该注射液中葡萄糖的物质的量浓度为____________ (保留两位有效数字);
(2)检查人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L 之间。若某人的血糖检查结果为92mg/dL,他的血糖正常吗?_________ (填“正常”或“不正常”)
Ⅱ.现有0.270kg质量分数为10%的CuCl2溶液,计算
(1)溶液中CuCl2的物质的量为___________ ;
(2)要将溶液中的Cl-完全沉淀,需加入1.0 mol/L的AgNO3溶液_______ mL;
(3)要将溶液中的铜完全置换出来,需加入Fe 的质量为__________ 。

(2)检查人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L 之间。若某人的血糖检查结果为92mg/dL,他的血糖正常吗?
Ⅱ.现有0.270kg质量分数为10%的CuCl2溶液,计算
(1)溶液中CuCl2的物质的量为
(2)要将溶液中的Cl-完全沉淀,需加入1.0 mol/L的AgNO3溶液
(3)要将溶液中的铜完全置换出来,需加入Fe 的质量为
您最近一年使用:0次
名校
8 . 无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
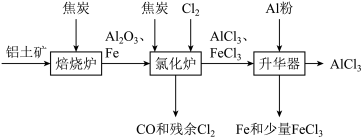
已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________ ,实验室配制氯化铝溶液时加入盐酸的目的是________________________ 。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________ 炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____ 。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________ 。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品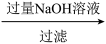 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3  n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________ 。计算该样品中Al的质量分数________ (结果用m、n表示,不必化简)。

已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品
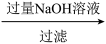 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3  n克Al2O3
n克Al2O3NaAlO2溶液与过量二氧化碳反应的离子方程式为:
您最近一年使用:0次
名校
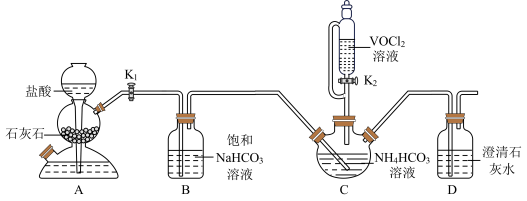
9 . 实验室可通过反应;3Cl2+6KOH 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。

请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_______________________________ 。
(2)请分析装置图,进行补充和完善。A部分缺___________ 装置,B部分还应补充____________ 装置,还有一处设计明显不合理的是___________ (填“A”“B”或“C”)
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:______________________________________ 。
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______________ ;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________ (不考虑Cl2的挥发)

(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 mol•L-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 mol•L-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为_________ 。(已知Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,C1O3-可被Fe2+还原为Cl-)
 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:
(2)请分析装置图,进行补充和完善。A部分缺
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离于方程式:
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是

(5)测定KClO3样品中C1O3-的含量,称取样品ag,准确配制成1000mL溶液,从上述溶液中取出10.00mL 于锥形瓶中,准确加入30.00mL 1.00 mol•L-1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100mL 蒸馏水及某种指示剂,用0.200 mol•L-1K2Cr2O7标准溶液滴定至终点,消耗5.00mL。样品中C1O3-的质量分数为
您最近一年使用:0次
2018-01-18更新
|
314次组卷
|
2卷引用:贵州省贵阳市第一中学2018届高三第五次适应性月考理综化学试题
10 . 水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
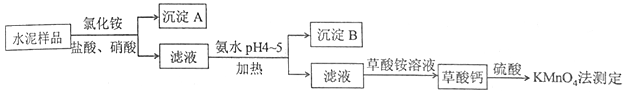
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________________________________ ,还可使用___________ 代替硝酸。
(2)沉淀A的主要成分是_________ ,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________ 。
(3)加氨水过程中加热的目的是______________________________________ 。沉淀B的主要成分为_____________ 、____________ (填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________ 。

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是
(2)沉淀A的主要成分是
(3)加氨水过程中加热的目的是
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
您最近一年使用:0次
2017-08-08更新
|
9823次组卷
|
25卷引用:贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题
贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅱ卷精编版)重庆市第二中学2018届高三3月测试化学试题西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题陕西省吴起高级中学2019届高三上学期期中考试化学试题安徽省亳州市第二中学2018-2019学年高二下学期期中考试化学试题百所名校联考-非金属及其化合物云南省漾濞二中2020届高三上学期开学考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训福建省福州第一中学2021届高三上学期期中考试化学试题宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题福建省长泰县第一中学2021届高三上学期11月考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题广东省广州市禺山高级中学2020-2021学年高二下学期第一阶段考试化学试题(已下线)专题四 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向10 碳、硅及其化合物-备战2022年高考化学一轮复习考点微专题黑龙江省哈尔滨市第三中学2021-2022学年上学期高三第三次验收考试化学试题广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)第四章 非金属及其化合物 第17讲 无机非金属材料



