1 . 钒是人体不可缺少的元素,Heyliger 等首次报道了偏钒酸钠显著降低糖尿病大鼠血糖的作用后,钒化学的研究得到了很大发展。钒及其化合物也广泛应用于特种钢、催化剂、颜料、染料、电子材料及防腐剂等等领域。
(1)钒酸盐与磷酸盐结构相似。请画出VO 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O 的空间构型
的空间构型__________ 。
(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式__________ 。
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图__________ 。
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因__________ 。
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式__________ 。
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由__________ 。
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下__________ 。
(1)钒酸盐与磷酸盐结构相似。请画出VO
 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O 的空间构型
的空间构型(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下
| 配离子 |  |
| [Fe(edta)]2- [Fe(edta)]- [Fe(phen)3]2+ [Fe(phen)3]3+ | 2.1×1014 1.7×1024 2.0×1021 1.3×1014 |
| 沉淀 | Ksp |
| Fe(OH)2 Fe(OH)3 | 8.0×10-16 4.0×10-38 |
您最近一年使用:0次
14-15高三上·上海宝山·阶段练习
名校
解题方法
2 . 某化工厂以甲烷为原料合成甲醇的反应为:(所有气体体积均已折算为标准状况)
反应器①中: CH4(g)+H2O(g)→CO(g)+3H2(g)
反应器②中: CO(g)+2H2(g)→CH3OH(g)
(该反应CO的转化率为 )
)
(1)在反应器①中通入体积为672m3的甲烷和足量的水蒸气,充分反应后通入反应器②,则反应剩余物中n(CO)=________________ ,n(H2)=__________________ 。
(2)为增大产量,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:反应器③中2CH4(g)+O2(g)→2CO(g)+4H2(g),若新工艺中充入反应器 ①的甲烷体积为a,水蒸气足量,反应器③的甲烷体积为b,最终反应产物中:V(CO)︰V(H2) = 1︰3。
①求充入反应器①③的甲烷的体积比a︰b=________ ;
②若最终反应剩余物中有N2,且V ( N2) = V(CO),则该空气中氧气的体积分数为多少?(要求:写出本小题的计算过程)________________
反应器①中: CH4(g)+H2O(g)→CO(g)+3H2(g)
反应器②中: CO(g)+2H2(g)→CH3OH(g)
(该反应CO的转化率为
 )
)(1)在反应器①中通入体积为672m3的甲烷和足量的水蒸气,充分反应后通入反应器②,则反应剩余物中n(CO)=
(2)为增大产量,该厂在原工艺的基础上,将下列反应运用于生产甲醇原料气:反应器③中2CH4(g)+O2(g)→2CO(g)+4H2(g),若新工艺中充入反应器 ①的甲烷体积为a,水蒸气足量,反应器③的甲烷体积为b,最终反应产物中:V(CO)︰V(H2) = 1︰3。
①求充入反应器①③的甲烷的体积比a︰b=
②若最终反应剩余物中有N2,且V ( N2) = V(CO),则该空气中氧气的体积分数为多少?(要求:写出本小题的计算过程)
您最近一年使用:0次
2012·上海·零模
解题方法
3 . 某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为:
 ①(反应中CH4转化率为1)
①(反应中CH4转化率为1)
 ②(反应中CH4转化率为1)
②(反应中CH4转化率为1)
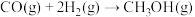 (反应中CO转化率为
(反应中CO转化率为 )
)
合成工艺如下:
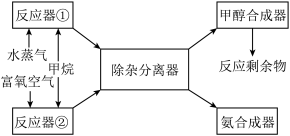
请回答下列问题(所有气体体积均折算为标准状况):
(1)若只用反应器①来直接合成甲醇。当充入反应器①的甲烷和水蒸气的体积分别为672m3和2240m3时,反应剩余物中CO为_____ mol、H2为_______ mol;
(2)若CH4同时和H2O(g)及O2(g)反应,则am3 CH4按上述两式完全反应,产物气体的体积V的范围为________ 。
(3)若充入反应器①的甲烷和水蒸气的体积分别为l体积和3体积,反应剩余物中: V(H2):V(N2):V(CO)=3:1:l。则充入反应器②的富氧空气(只含N2和H2)的体积为_______ ;富氧空气中氧气体积分数为____ 。
(4)若将25%的富氧空气、CH4和H2O(g)混合并充分反应,反应的产物中n(H2):n(N2)=3:1,来合成氨气,则反应中的H2O(g)富氧空气的物质的量之比为_______ 。
 ①(反应中CH4转化率为1)
①(反应中CH4转化率为1) ②(反应中CH4转化率为1)
②(反应中CH4转化率为1)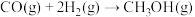 (反应中CO转化率为
(反应中CO转化率为 )
)合成工艺如下:

请回答下列问题(所有气体体积均折算为标准状况):
(1)若只用反应器①来直接合成甲醇。当充入反应器①的甲烷和水蒸气的体积分别为672m3和2240m3时,反应剩余物中CO为
(2)若CH4同时和H2O(g)及O2(g)反应,则am3 CH4按上述两式完全反应,产物气体的体积V的范围为
(3)若充入反应器①的甲烷和水蒸气的体积分别为l体积和3体积,反应剩余物中: V(H2):V(N2):V(CO)=3:1:l。则充入反应器②的富氧空气(只含N2和H2)的体积为
(4)若将25%的富氧空气、CH4和H2O(g)混合并充分反应,反应的产物中n(H2):n(N2)=3:1,来合成氨气,则反应中的H2O(g)富氧空气的物质的量之比为
您最近一年使用:0次
解题方法
4 . 已知:CO和H2在Co做催化剂、温度为160℃~200℃时,可以合成汽油(即分子中含5至8个碳原子的烷烃).
(1)用CnH2n+2表示汽油,写出上述反应的化学方程式_______ (需配平)
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的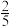 ,通过计算说明是否生成汽油
,通过计算说明是否生成汽油______________________ .
(3)以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油.(流程示意图如下,反应③的H2也由反应①得到.)
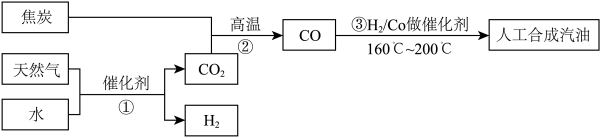
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油.
(a)通过计算说明上述方案能否得到理想的产品________________ .
(b)当CO2的使用量应控制为反应①中CO2产量的_____ (填比例范围),可以得到理想的产品.
(1)用CnH2n+2表示汽油,写出上述反应的化学方程式
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的
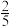 ,通过计算说明是否生成汽油
,通过计算说明是否生成汽油(3)以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油.(流程示意图如下,反应③的H2也由反应①得到.)

若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油.
(a)通过计算说明上述方案能否得到理想的产品
(b)当CO2的使用量应控制为反应①中CO2产量的
您最近一年使用:0次
2010·上海·零模
5 . CO和CO2都可以合成甲醇:CO+2H2→CH3OH;CO2+3H2→CH3OH+H2O,CO、CO2和H2可通过下列反应制备:①CH4+H2O(g) →CO+3H2 ;②CO+H2O(g) →CO2+H2;反应①的产物合成甲醇时H2过量,反应②的的产物合成甲醇时H2不足。为了充分利用原料,可将两个反应的产物混合使用。
(1)以CH4、CO、H2O混合气体为原料气,在一定条件下充分反应,所得气体以合成甲醇,为使原子的利用率达到最高,则CH4、CO、H2O的最佳配比为__________ 。
(2)若以100L CH4和H2O的混合气体为原料,制备CO、CO2和H2混合气体,当CH4和H2O均完全反应后,在相同条件下反应后气体的体积为______________ L(写范围)。
(3)若以100L CH4和H2O的混合气体,充分反应后,测得同温同压下气体的体积为180L,求原混合气体中CH4和H2O的体积比为__________ 。
(4)在100L CH4和H2O的混合气体中,CH4所占的体积分数为x,反应后气体的体积为y(L),求:x的取值范围和气体产物的体积y(用含x的函数表达式)__________
(1)以CH4、CO、H2O混合气体为原料气,在一定条件下充分反应,所得气体以合成甲醇,为使原子的利用率达到最高,则CH4、CO、H2O的最佳配比为
(2)若以100L CH4和H2O的混合气体为原料,制备CO、CO2和H2混合气体,当CH4和H2O均完全反应后,在相同条件下反应后气体的体积为
(3)若以100L CH4和H2O的混合气体,充分反应后,测得同温同压下气体的体积为180L,求原混合气体中CH4和H2O的体积比为
(4)在100L CH4和H2O的混合气体中,CH4所占的体积分数为x,反应后气体的体积为y(L),求:x的取值范围和气体产物的体积y(用含x的函数表达式)
您最近一年使用:0次
真题
解题方法
6 . CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_______ L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______ 。
(3)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2,4KO2+4CO2+2H2O→4KHCO3+3O2,若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少_______ ?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O CO+3H2,已知:CO+2H2
CO+3H2,已知:CO+2H2 CH3OH,CO2+3H2
CH3OH,CO2+3H2 CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率
CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______ 。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为
(3)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2,4KO2+4CO2+2H2O→4KHCO3+3O2,若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O
 CO+3H2,已知:CO+2H2
CO+3H2,已知:CO+2H2 CH3OH,CO2+3H2
CH3OH,CO2+3H2 CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率
CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率
您最近一年使用:0次
2016-12-09更新
|
293次组卷
|
6卷引用:2016年全国普通高等学校招生统一考试化学(上海卷精编版)
2016年全国普通高等学校招生统一考试化学(上海卷精编版)2016年全国普通高等学校招生统一考试化学(上海卷参考版)人教版2017届高三单元精练检测一化学试题(已下线)2019年高考化学一轮复习讲练测1.2 物质的量浓度 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【教学案】(已下线)2019高考备考二轮复习精品资料-专题2 化学常用计量(教学案)
7 . 工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________ ,若所得硝酸密度为ρg/cm3,则其物质的量浓度为_______ (保留两位小数)。
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为________ m3(保留两位小数)。
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数_____________ 。
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。_____________
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H22CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。
您最近一年使用:0次
2015-06-02更新
|
418次组卷
|
2卷引用:2015届上海市闵行区高三下学期质量调研考试(二模)化学试卷
8 . 硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2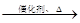 4NO+6H2O ----①
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是_________________ (保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是_______ mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量__________ (写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?
_________________________ (富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?__________________________ (写出计算过程)
4NH3+5O2
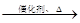 4NO+6H2O ----①
4NO+6H2O ----①4NO+3O2+2H2O→4HNO3----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?
您最近一年使用:0次
2015-06-25更新
|
344次组卷
|
2卷引用:2015届上海市普陀区高三4月质量调研(二模)化学试卷



