解题方法
1 . 工业上常以铝土矿为原料来冶炼金属铝。已知:铝土矿的主要成分是 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:
①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。___________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为___________ ,其物质的量为___________ 。
(3)该铝土矿样中 的质量分数为
的质量分数为___________ 。
 (其中含有
(其中含有 、
、 等杂质)。为检测某铝土矿样品中
等杂质)。为检测某铝土矿样品中 的含量,进行如下实验过程:
的含量,进行如下实验过程:①取矿样10.0g加入过量稀盐酸溶解,过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.0mL逐滴加入
 的NaOH溶液。得到如右图所示的变化关系。
的NaOH溶液。得到如右图所示的变化关系。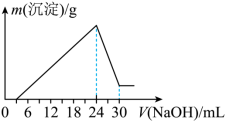
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该铝土矿样中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
2 . 某实验小组以 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
步骤2,产品中 的含量测定
的含量测定
①称取产品 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的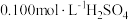 溶液,
溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为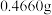 。
。
产品中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:步骤2,产品中
 的含量测定
的含量测定①称取产品
 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的
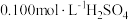 溶液,
溶液,③沉淀完全后,
 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为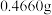 。
。产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4·5H2O的质量分数为_______ (列出算式可能用到的化学式量:CuSO4 160、CuSO4·5H2O 250、Cu(NO3)2·3H2O 242、BaSO4 233)。
您最近一年使用:0次
解题方法
4 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
5 . 完成下列问题
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值_______ (列出计算过程)。
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=_______ 。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值
(2)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+,写出计算CuSO4·5H2O质量分数的表达式ω=
您最近一年使用:0次
21-22高一·全国·假期作业
6 . 回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3→Se+I2+KNO3+H2O(未配平)②I2+Na2S2O3→Na2S4O6+NaI(未配平)实验中,准确称量SeO2样品0.1500g,消耗0.2000mol·L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为____ 。
您最近一年使用:0次
2022高三·全国·专题练习
7 . 碳酸钠产品中 含量测定:
含量测定:
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸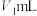 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸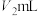 ;
;
④平行测定三次,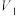 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
开始分解。
(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
(1)产品中 的质量分数为
的质量分数为___________ (保留三位有效数字);
(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果___________ (填“偏大”“偏小”或“无影响”)。
 含量测定:
含量测定:①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸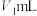 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸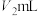 ;
;④平行测定三次,
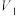 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。已知:(i)当温度超过35℃时,
 开始分解。
开始分解。(ii)相关盐在不同温度下的溶解度表(g/100gH2O)
温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
 | 11.9 | 15.8 | 21.0 | 27.0 | |||
 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
 的质量分数为
的质量分数为(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
8 . 已知CaO2在350 ℃迅速分解生成CaO和O2.如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
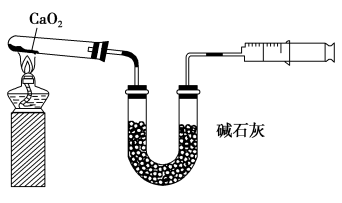
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为___________ (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有___________ 。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
9 . 某种胃药的有效成分为碳酸钙,某实验小组为测定其中碳酸钙的含量,取10粒药片(0.1 g/粒)研碎后溶解。加入25.00 mL 1.0 mol/L的稀盐酸反应,最后用1.0 mol/LNaOH溶液中和过量的盐酸,测定所消耗的NaOH的溶液体积如下:
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为___________ mL。
(2)药片中碳酸钙的质量分数为___________ 。
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(NaOH)/mL | 13.00 | 12.90 | 11.40 | 13.10 |
(1)配制100 mL 1.0 mol/L的稀盐酸,需要2.5 mol/L的盐酸的体积为
(2)药片中碳酸钙的质量分数为
您最近一年使用:0次
10 . 为了测定镁铝合金中各成分金属的含量,可采取以下两种方法:
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为_______ 。
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
则盐酸的物质的量浓度为____ (保留三位有效数字),合金中镁铝的物质的量之比____ 。
(1)将8g镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣4.4g,则合金样品中铝的质量分数为
(2)在标准状况下进行甲、乙、丙三组实验:各取200mL同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 2.55 | 3.85 | 4.59 |
| 生成气体体积/L | 2.80 | 3.36 | 3.36 |
则盐酸的物质的量浓度为
您最近一年使用:0次



