1 . 小明同学在化学兴趣小组中提出一个猜想:“根据学习过的化学反应CaCO3+CO2+H2O=Ca(HCO3)2可以知道,Na2CO3溶液也能与CO2发生反应”。
为了确定小明同学猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法,完成了对该猜想的判。请你完成兴趣小组在实验探究活动中的部分实验报告。
【实验目的】:探究Na2CO3溶液与CO2的反应
【实验药品】:Na2CO3溶液、饱和的NaHCO3溶液、大理石、CaCl2、CaO、稀盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:NaHCO3与Ca(OH)2发生反应:2NaHCO3+ Ca(OH)2=CaCO3↓+Na2CO3+2H2O,碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳。
【实验装置】;
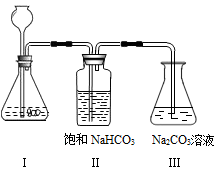
【实验操作步骤与现象】
①写出实验室制取二氧化碳的化学方程式__________________ 。
②将制取的CO2通过饱和的NaHCO3溶液洗气瓶的目的是_____________ 。
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入______ 试剂(请从以上给出的药品中选择)当试管中出现_______ 现象时,Na2CO3溶液与CO2发生了化学反应,其反应的化学方程式为____________________________________ 。
【结论】:通过实验探究,小明同学的猜想是正确的。
【应用】:你能否依据此化学反应的规律,再写出一个类似的化学反应方程式(写上述已有的两个反应
不得分):________________________________ 。
为了确定小明同学猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法,完成了对该猜想的判。请你完成兴趣小组在实验探究活动中的部分实验报告。
【实验目的】:探究Na2CO3溶液与CO2的反应
【实验药品】:Na2CO3溶液、饱和的NaHCO3溶液、大理石、CaCl2、CaO、稀盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:NaHCO3与Ca(OH)2发生反应:2NaHCO3+ Ca(OH)2=CaCO3↓+Na2CO3+2H2O,碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳。
【实验装置】;

【实验操作步骤与现象】
①写出实验室制取二氧化碳的化学方程式
②将制取的CO2通过饱和的NaHCO3溶液洗气瓶的目的是
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入
【结论】:通过实验探究,小明同学的猜想是正确的。
【应用】:你能否依据此化学反应的规律,再写出一个类似的化学反应方程式(写上述已有的两个反应
不得分):
您最近一年使用:0次
2 . 如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
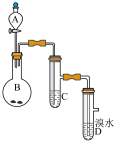
(1)实验开始前,首先进行的操作是___ ;
(2)实验室制备乙炔的方程式为___ ;
(3)仪器A在安装前必须进行的操作是___ ,为防止气体生成的速率过快,由A滴入B的试剂为___ 。
(4)装置C可选用的试剂为___ (写出一种即可),其作用为___ ;
(5)反应开始后,D中的现象为___ ,所发生反应的反应类型为___ ;
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___ 。

(1)实验开始前,首先进行的操作是
(2)实验室制备乙炔的方程式为
(3)仪器A在安装前必须进行的操作是
(4)装置C可选用的试剂为
(5)反应开始后,D中的现象为
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是

您最近一年使用:0次
2019-11-13更新
|
865次组卷
|
4卷引用:安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题
安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题云南省云天化中学2019-2020学年高二上学期期中考试化学试题(已下线)2.2.2 炔烃-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)第二章 烃
名校
解题方法
3 . 实验室常用NaOH溶液吸收NO2尾气,探究其适宜条件原理。20℃时,将4mL不同浓度NaOH溶液一次性推入中40mLNO2,观察现象。
(1)NaOH溶液吸收NO2时生成两种钠盐,分别为NaNO2和_____ 。
(2)检验甲中剩余气体的方法:排出大注射器中的溶液,拔下导管,吸入少量空气,气体变为红棕色。用化学方程式表示检验的反应原理是_____ 。
(3)某同学推测甲中产生无色气体的原因:局部OH-浓度过低,导致部分NO2与水反应。通过实验证明其成立:用与甲相同的装置、试剂和条件,将NO2缓慢推入NaOH溶液中,_____ (补全实验现象)。
(4)进一步探究NO2与水或碱反应时还原产物价态不同的原理。
【查阅资料】
i.NO2遇水时发生反应:a.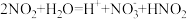
b.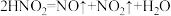 ;
;
ii.酸性条件下,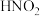 或
或 可与对氨基苯磺酸发生
可与对氨基苯磺酸发生不可逆 反应,所得产物遇萘乙二胺变红,且原溶液中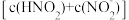 越大,红色越深。
越大,红色越深。
【实验】将2mLNO2推入5mL下列试剂中,随即取出0.1mL溶液,滴加到等量对氨基苯磺酸溶液(盐酸酸化)中,再加入等量萘乙二胺溶液,加水定容到相同体积,对比溶液颜色。
①通过实验_____ (填编号)对比,说明NO2遇水时发生了反应a和b。
②从化学反应速率的角度分析,NO2与水或碱反应时还原产物价态不同的原因是_____ 。
(5)若用0℃的NaOH溶液重复实验甲,最终剩余约3mL(20℃)无色气体。
综上,用NaOH溶液吸收NO2尾气,适宜的条件是______ (写出两点即可)。
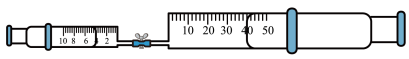
| 编号 | c(NaOH) | 现象 |
| 甲 | 2mol•L-1 | 活塞自动内移,最终剩余约7mL无色气体 |
| 乙 | 6mol•L-1 | 活塞自动内移,最终气体全部被吸收 |
(2)检验甲中剩余气体的方法:排出大注射器中的溶液,拔下导管,吸入少量空气,气体变为红棕色。用化学方程式表示检验的反应原理是
(3)某同学推测甲中产生无色气体的原因:局部OH-浓度过低,导致部分NO2与水反应。通过实验证明其成立:用与甲相同的装置、试剂和条件,将NO2缓慢推入NaOH溶液中,
(4)进一步探究NO2与水或碱反应时还原产物价态不同的原理。
【查阅资料】
i.NO2遇水时发生反应:a.
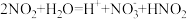
b.
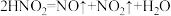 ;
;ii.酸性条件下,
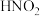 或
或 可与对氨基苯磺酸发生
可与对氨基苯磺酸发生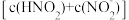 越大,红色越深。
越大,红色越深。【实验】将2mLNO2推入5mL下列试剂中,随即取出0.1mL溶液,滴加到等量对氨基苯磺酸溶液(盐酸酸化)中,再加入等量萘乙二胺溶液,加水定容到相同体积,对比溶液颜色。
| 编号 | 试剂 | 溶液颜色 |
| 丙 | 水 | 溶液均呈红色,丁与戊颜色几乎相同,丙的颜色更浅 |
| 丁 | 6mol•L-1NaOH溶液 | |
| 戊 | 酸性对氨基苯磺酸溶液 |
②从化学反应速率的角度分析,NO2与水或碱反应时还原产物价态不同的原因是
(5)若用0℃的NaOH溶液重复实验甲,最终剩余约3mL(20℃)无色气体。
综上,用NaOH溶液吸收NO2尾气,适宜的条件是
您最近一年使用:0次
2023-04-01更新
|
1314次组卷
|
7卷引用:安徽省合肥六校联考2023-2024学年高三上学期期中联考化学试题
4 . 实验室里用下图所示仪器和药品制取纯净的无水氯化铁。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出,其中⑤、⑥所用为双孔塞,


根据要求回答下列问题:
(1)如果规定气体从左向右流动,上述各仪器装置的正确连接顺序是(填装置的序号):
③→______ →______ →_______ →_______ →_______ 。
(2)装置④的作用是_______________ 。
(3)实验开始时,应首先______________ ;实验结束时,应先熄灭装置__________ 处的酒精灯。该实验条件下生成的氯化铁呈烟状,且易水解,为便于收集,需要在__________ 和__________ (填装置序号)之间增加装置⑦,该装置中烧杯里的液体可以是___________ 。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为__________________ 。
(5)可用离子交换和滴定的方法测定FeCl3的纯度:称取0.68g的FeCl3样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH―的阴离子交换柱,使Cl―和OH―发生交换。交换完成后,流出溶液中的OH―用0.4000 mol/L的盐酸滴定,滴至终点时消耗盐酸30.00 mL。则该样品中FeCl3的质量分数为___________ %。
(6)设计一个简单实验,证明装置①的硬质玻璃管中有少量的铁未能与Cl2发生反应(写出实验操作及相关实验现象)_________________ 。


根据要求回答下列问题:
(1)如果规定气体从左向右流动,上述各仪器装置的正确连接顺序是(填装置的序号):
③→
(2)装置④的作用是
(3)实验开始时,应首先
(4)在装置⑤的烧瓶中,发生反应的化学方程式为
(5)可用离子交换和滴定的方法测定FeCl3的纯度:称取0.68g的FeCl3样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH―的阴离子交换柱,使Cl―和OH―发生交换。交换完成后,流出溶液中的OH―用0.4000 mol/L的盐酸滴定,滴至终点时消耗盐酸30.00 mL。则该样品中FeCl3的质量分数为
(6)设计一个简单实验,证明装置①的硬质玻璃管中有少量的铁未能与Cl2发生反应(写出实验操作及相关实验现象)
您最近一年使用:0次
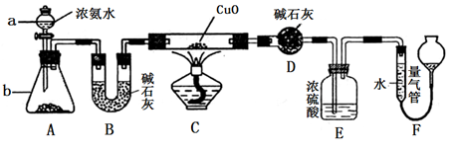
5 . 某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为________ ;仪器b中可选择的试剂为________ ;
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是( )
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有还原性,写出相应的化学方程式_____________________ .
(4)E装置中浓硫酸的作用_____________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为_____________ (用含m、n字母的代数式表示)
(1)仪器a的名称为

(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有还原性,写出相应的化学方程式
(4)E装置中浓硫酸的作用
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为
您最近一年使用:0次
12-13高三下·安徽安庆·阶段练习
6 . 硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是_______ 。
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。
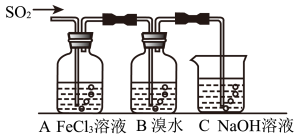
(2)下列实验方案可以用于在实验室制取所需SO2的是_______________________ 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(3)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO ):n(HSO
):n(HSO )变化关系如下表
)变化关系如下表
当吸收液中n(SO ):n(HSO
):n(HSO )=10:1时,溶液中离子浓度关系正确的是
)=10:1时,溶液中离子浓度关系正确的是____________________ 。
A.c(Na+)+ c(H+)= 2c(SO )+ c(HSO
)+ c(HSO )+ c(OH—)
)+ c(OH—)
B.c(Na+)>c(HSO >c(SO
>c(SO )>c(OH—)>c(H+)
)>c(OH—)>c(H+)
C.c(Na+)>c(SO )>c(HSO
)>c(HSO )>c(OH—)>c(H+)
)>c(OH—)>c(H+)
(4)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
上述方案①得出的结论是否合理____________________ ,原因_______________________________ 。如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整___________________ ,___________________ 。
(5)装置B中能表明Br—的还原性弱于SO2的现象是__________________________ 。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

(2)下列实验方案可以用于在实验室制取所需SO2的是
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(3)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO
 ):n(HSO
):n(HSO )变化关系如下表
)变化关系如下表| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
 ):n(HSO
):n(HSO )=10:1时,溶液中离子浓度关系正确的是
)=10:1时,溶液中离子浓度关系正确的是A.c(Na+)+ c(H+)= 2c(SO
 )+ c(HSO
)+ c(HSO )+ c(OH—)
)+ c(OH—)B.c(Na+)>c(HSO
 >c(SO
>c(SO )>c(OH—)>c(H+)
)>c(OH—)>c(H+)C.c(Na+)>c(SO
 )>c(HSO
)>c(HSO )>c(OH—)>c(H+)
)>c(OH—)>c(H+)(4)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | SO2与Fe3+反应生成了Fe2+ | |
| 方案③ | 往第二份试液中加入 | SO2与Fe3+反应生成了SO |
(5)装置B中能表明Br—的还原性弱于SO2的现象是
您最近一年使用:0次
名校
解题方法
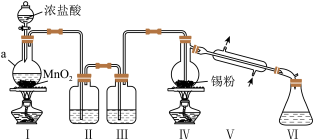
7 . SnCl4可用于染色时的媒染剂、润滑油添加剂、玻璃表面处理剂等。实验室可以通过如下图装置制备少量SnCl4(夹持装置略)。
已知:①锡的熔点232℃、沸点2260℃;
②SnCl2的熔点246.8℃、沸点623℃;③SnCl4的熔点-33℃、沸点114℃,SnCl4极易水解。
通常将SnCl4晶体加入浓盐酸中,以配制无色的SnCl4溶液。回答下列问题:
(1)仪器a的名称为_______ ,该仪器中发生反应的离子方程式为_______ 。
(2)装置II的作用是_______ ,如果去掉装置II,从实验安全的角度看可能产生的影响是_______ 。
(3)装置III中的试剂为_______ 。下图中可替代装置III的是_______ (填字母序号,下同)。
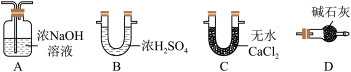
(4)该实验装置存在一处明显的缺陷,改进方法为在装置VI后连接上图中的_______ 。
(5)作为变价金属的高价离子,Sn4+和Fe3+均有氧化性。请设计实验验证Sn4+和Fe3+的氧化性强弱_______ 。

已知:①锡的熔点232℃、沸点2260℃;
②SnCl2的熔点246.8℃、沸点623℃;③SnCl4的熔点-33℃、沸点114℃,SnCl4极易水解。
通常将SnCl4晶体加入浓盐酸中,以配制无色的SnCl4溶液。回答下列问题:
(1)仪器a的名称为
(2)装置II的作用是
(3)装置III中的试剂为

(4)该实验装置存在一处明显的缺陷,改进方法为在装置VI后连接上图中的
(5)作为变价金属的高价离子,Sn4+和Fe3+均有氧化性。请设计实验验证Sn4+和Fe3+的氧化性强弱
您最近一年使用:0次
8 . 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:

(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开能分解,且分解产物只有硫化钠和另种固体。如果加热温度低于字600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为_____________ ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生生成黄色沉淀的离子方程式为_______________ ;此时在B、C两装置中可能观察到的现象为______________ 。
(3)在(2)中滴加定量盐酸后,烧瓶内除Cl-外还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),认为合理的方案是_______ (填“甲”或“乙”),请说明另一种方案不合理的原因____________ 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式_________ 。

(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开能分解,且分解产物只有硫化钠和另种固体。如果加热温度低于字600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生生成黄色沉淀的离子方程式为
(3)在(2)中滴加定量盐酸后,烧瓶内除Cl-外还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),认为合理的方案是
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式
您最近一年使用:0次
2016-12-09更新
|
439次组卷
|
4卷引用:2015-2016学年安徽师大附中高一下学期期中考查化学试卷
2015-2016学年安徽师大附中高一下学期期中考查化学试卷(已下线)2014届湖北省襄阳市襄州一中等四校高三上学期期中联考化学试卷2016届河北省衡水市冀州中学高三复习班上月考化学试卷2017届河南省周口市淮阳中学高三上10月月考化学试卷
9 . 固体硝酸盐加热易分解且产物较复杂。已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
I.2KNO3 2KNO2+O2↑
2KNO2+O2↑
II.2Cu(NO3) 2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
III.2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6. (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为___________ 。
②若该固体是混合物,则该混合物的可能组成为___________ 。
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
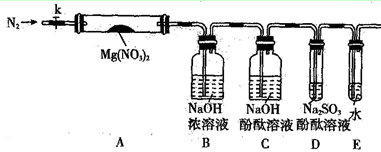
【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
①步骤a的目的是___________ ;
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为:___________ 。
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为___________ ,用离子方程式表示出现该现象的原因:___________ 。
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?___________ 。
I.2KNO3
 2KNO2+O2↑
2KNO2+O2↑II.2Cu(NO3) 2
 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑III.2AgNO3
 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑(1)某固体可能由KNO3、Cu(NO3)2、AgNO3三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6. (忽略氧在水中的溶解)
①若该固体只是由一种盐组成,则该盐为
②若该固体是混合物,则该混合物的可能组成为
(2)某学习小组以Mg(NO3)2为研究对象,通过实验探究其热分解的产物,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

【实验步骤】
a.仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管A。
b.称取Mg(NO3)2固体3.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
①步骤a的目的是
②依据已知的三个方程式,再根据剩余固体的质量写出Mg(NO3)2热分解方程式为:
③若A中固体为AgNO3,用以上实验装置进行实验时,D 中的现象为
④从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?
您最近一年使用:0次
10 . 某化学兴趣小组为了探究AgNO3的性质,通过查阅资料和老师指导设计了如下实验:
Ⅰ.探究AgNO3的氧化性
实验方法:将光亮的铁丝伸入新配制的AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,先将溶液中的Ag除尽后,进行了如下实验。可选用的试剂:蒸馏水、稀氨水、KSCN溶液、高锰酸钾酸性溶液、新制氯水。
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe3+。
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束后,试管中残留同体为黑色。
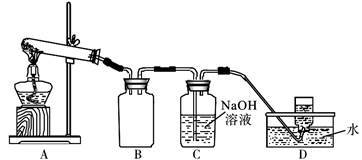
(2)装置B的作用是________________________ 。
(3)经小组讨论并验证该无色气体为O2,其验证方法是___________________________________ 。
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水和稀硝酸。
【提出设想】试管中残留的黑色同体可能是:i.Ag;ii.Ag2O;iii.__________________ 。
【实验验证】该小组为验证上述设想iii是否成立,进行了如下实验(仪器和药品任选)
【实验结论】若假设i成立,该小组得出AgNO3固体热分解反应的化学方程式为______________ 。
Ⅰ.探究AgNO3的氧化性
实验方法:将光亮的铁丝伸入新配制的AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,先将溶液中的Ag除尽后,进行了如下实验。可选用的试剂:蒸馏水、稀氨水、KSCN溶液、高锰酸钾酸性溶液、新制氯水。
(1)请完成下表:
| 实验操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中, | 存在Fe3+ | |
| 取少量除尽Ag+后的溶液于试管中, | 不存在Fe2+ |
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束后,试管中残留同体为黑色。

(2)装置B的作用是
(3)经小组讨论并验证该无色气体为O2,其验证方法是
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水和稀硝酸。
【提出设想】试管中残留的黑色同体可能是:i.Ag;ii.Ag2O;iii.
【实验验证】该小组为验证上述设想iii是否成立,进行了如下实验(仪器和药品任选)
| 实验操作 | 现象和结论 |
您最近一年使用:0次



