名校
1 . 碘化钠在有机合成、医疗及食品等方面用途广泛,有多种制备方法,下图是“水合肼还原法”制备碘化钠的一种方案。

已知:①3I 2+ 6NaOH =5NaI+ NaIO3 + 3H2O。
②水合肼(N2H4·H2O)有还原性,沸点118°C,100°C开始分解。
回答下列问题:
(1)装置图中仪器a的名称为___________ 。若要使分液漏斗中的水合肼顺利流入三颈烧瓶中,具体的操作是___________ 。
(2)实验过程中需控制反应温度在70°C左右,原因是___________ 。装置图中加热的方式最好选用___________ 。
(3)肼(N2H4)的电子式为___________ 。制备过程中,N2H4· H2O参与反应的离子方程式为___________ 。工业上也可用其他方法制备NaI,但“水合肼还原法”的优点是___________ 。
(4)测定产品中NaI的含量,采用电位滴定法测定,实验步骤如下:

产品中NaI的质量分数是___________ 。

已知:①3I 2+ 6NaOH =5NaI+ NaIO3 + 3H2O。
②水合肼(N2H4·H2O)有还原性,沸点118°C,100°C开始分解。
回答下列问题:
(1)装置图中仪器a的名称为
(2)实验过程中需控制反应温度在70°C左右,原因是
(3)肼(N2H4)的电子式为
(4)测定产品中NaI的含量,采用电位滴定法测定,实验步骤如下:

产品中NaI的质量分数是
您最近一年使用:0次
名校
2 . 下列说法正确的是
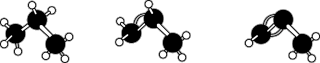

| A.丙烷、丙烯、丙炔的球棍模型分别为如图 |
| B.有机物中碳的质量分数最高的物质是乙炔 |
| C.卤代烃均难溶于水,且密度比水大 |
| D.利用溴水可以区分乙醇、己烯、四氯化碳、己烷 |
您最近一年使用:0次
名校
3 . 亚硝酰氯(NOCl)是有机物合成中的重要试剂,是一种红褐色液体或黄色气体,遇水易水解。某化学小组利用NO和 在实验室中制备NOCl,装置如图。
在实验室中制备NOCl,装置如图。

已知:沸点 为-34℃、NO为-152℃、NOCl为-6℃。NOCl易水解,能与
为-34℃、NO为-152℃、NOCl为-6℃。NOCl易水解,能与 反应。
反应。
回答下列问题:
(1)NOCl分子中各原子均满足8电子的稳定结构,则NOCl的电子式为_______ 。
(2)仪器a的名称:_______ 。
(3)NO和氯气混合前,先关闭 ,打开
,打开 、
、 ,操作的目的为
,操作的目的为_______ 。
(4)装置D中的温度区间应控制在_______ 。
(5)上述实验装置有一处不足,请指出不足之处:_______ 。
(6)亚硝酰氯(NOCl)纯度的测定。取D中所得液体20g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL样品溶液于锥形瓶中,滴加适量试剂X,用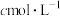
 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
①亚硝酰氯(NOCl)与NaOH溶液反应的方程式为_______ 。
②已知:
试剂X为_______ 。
A.NaBr B.NaI C. D.
D.
③亚硝酰氯(NOCl)的质量分数为_______ 。
 在实验室中制备NOCl,装置如图。
在实验室中制备NOCl,装置如图。
已知:沸点
 为-34℃、NO为-152℃、NOCl为-6℃。NOCl易水解,能与
为-34℃、NO为-152℃、NOCl为-6℃。NOCl易水解,能与 反应。
反应。回答下列问题:
(1)NOCl分子中各原子均满足8电子的稳定结构,则NOCl的电子式为
(2)仪器a的名称:
(3)NO和氯气混合前,先关闭
 ,打开
,打开 、
、 ,操作的目的为
,操作的目的为(4)装置D中的温度区间应控制在
(5)上述实验装置有一处不足,请指出不足之处:
(6)亚硝酰氯(NOCl)纯度的测定。取D中所得液体20g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL样品溶液于锥形瓶中,滴加适量试剂X,用
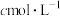
 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。①亚硝酰氯(NOCl)与NaOH溶液反应的方程式为
②已知:
| 物质 | AgCl | AgBr | AgI |  | AgSCN |  |
 |  |  | 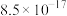 | 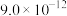 |  | 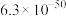 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 | 白色 | 灰黑色 |
A.NaBr B.NaI C.
 D.
D.
③亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
名校
4 . 氢是宇宙中含量最高的元素,占宇宙总质量的75%,应用前景十分广阔。
(1)H可与N形成多种分子,其中某分子含18个e-、6个原子,则该分子的结构式为___________ 。
(2)工业上用C和H2O制取H2。已知:
①C(s) + H2O(g) = H2(g) + CO(g) ΔH1
②C(s) + 2H2O(g) = 2H2(g) + CO2(g) ΔH2
则CO(s) + H2O(g) = H2(g) + CO2(g) ΔH =___________ (用ΔH1、ΔH2表示)。
(3)NaBH4是一种重要的储氢载体。
①B在元素周期表中的位置为___________ 。
②NaBH4(s)与H2O (l)反应生成NaBO2(s)和一种气体,在25℃,101kPa下,已知每消耗3.8g NaBH4放热21.6kJ,则该反应的热化学方程式为___________ ;反应前后B的化合价不变,则反应消耗1molNaBH4时转移的电子数目为___________ 。
(1)H可与N形成多种分子,其中某分子含18个e-、6个原子,则该分子的结构式为
(2)工业上用C和H2O制取H2。已知:
①C(s) + H2O(g) = H2(g) + CO(g) ΔH1
②C(s) + 2H2O(g) = 2H2(g) + CO2(g) ΔH2
则CO(s) + H2O(g) = H2(g) + CO2(g) ΔH =
(3)NaBH4是一种重要的储氢载体。
①B在元素周期表中的位置为
②NaBH4(s)与H2O (l)反应生成NaBO2(s)和一种气体,在25℃,101kPa下,已知每消耗3.8g NaBH4放热21.6kJ,则该反应的热化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为 、
、 ),还有少量
),还有少量 、
、 、
、 )制备PbO的流程如下:
)制备PbO的流程如下:

回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是___________ 。
(2)向废铅膏粉中加入NaOH溶液可将 转化为PbO,反应的离子方程式是
转化为PbO,反应的离子方程式是___________ 。
(3)溶液I中主要含有的阴离子有 、
、___________ 。
(4)加入 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为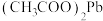 。
。 的电子式为
的电子式为___________ , 转化为
转化为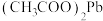 的化学方程式是
的化学方程式是___________ 。
(5)若废铅膏中铅元素的质量分数为69%,用上述流程对1kg废铅膏进行处理,得到669gPbO,则铅的回收率为___________ %。[M(Pb)=207、M(O)=16]
 、
、 ),还有少量
),还有少量 、
、 、
、 )制备PbO的流程如下:
)制备PbO的流程如下:
回答下列问题:
(1)步骤①将废铅膏研磨过筛的目的是
(2)向废铅膏粉中加入NaOH溶液可将
 转化为PbO,反应的离子方程式是
转化为PbO,反应的离子方程式是(3)溶液I中主要含有的阴离子有
 、
、(4)加入
 溶液和
溶液和 溶液可将脱硫铅膏中的含铅物质转化为
溶液可将脱硫铅膏中的含铅物质转化为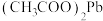 。
。 的电子式为
的电子式为 转化为
转化为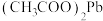 的化学方程式是
的化学方程式是(5)若废铅膏中铅元素的质量分数为69%,用上述流程对1kg废铅膏进行处理,得到669gPbO,则铅的回收率为
您最近一年使用:0次
2022-11-27更新
|
209次组卷
|
2卷引用:四川省成都市树德中学2022-2023学年高二上学期11月阶段性测试化学试题
名校
解题方法
6 . 下列说法不正确的是
| A.烷烃的通式为CnH2n+2,随n的增大,碳元素的质量分数逐渐减小 |
B. 和 和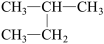 互为同一物质 互为同一物质 |
C.丙烷的球棍模型为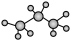 |
| D.分子式为C2H6和分子式为C5H12的一种烷烃的一氯代物的数目可能相同 |
您最近一年使用:0次
7 . A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性。G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)ACD形成的化合物含的化学键有___________ 。
(2)D单质与C单质在加热条件下反应产物的电子式___________ ,该物质与 反应的离子方程式
反应的离子方程式___________ 。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为___________ 。
(4)E的最高价氧化物对应水合物的浓溶液在加热条件下加入过量的G单质,反应的化学方程式为___________
(5)用电子式写出 的形成过程
的形成过程___________ 。
(1)ACD形成的化合物含的化学键有
(2)D单质与C单质在加热条件下反应产物的电子式
 反应的离子方程式
反应的离子方程式(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为
(4)E的最高价氧化物对应水合物的浓溶液在加热条件下加入过量的G单质,反应的化学方程式为
(5)用电子式写出
 的形成过程
的形成过程
您最近一年使用:0次
名校
解题方法
8 . 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,M为红褐色。
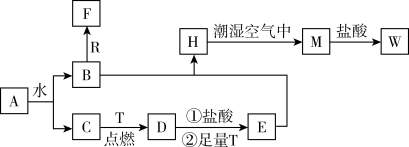
请回答下列问题:
(1)A的电子式是______ ,R元素在元素周期表中位置为______ ,D的俗称是______ 。
(2)A与水反应的离子方程式为__________________ 。
(3)检验W溶液中金属阳离子的操作方法是__________________ 。
(4)H转化为M的化学方程式为__________________ 。

请回答下列问题:
(1)A的电子式是
(2)A与水反应的离子方程式为
(3)检验W溶液中金属阳离子的操作方法是
(4)H转化为M的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 化学元素周期表(Periodictableofelements)是根据元素原子核电荷数从小至大排序的化学元素列表。如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y、Z分别表示某种化学元素),按要求作答。
(1)Z元素符号是___________ 。
(2)表中元素化学性质最稳定的是___________ (填元素符号)。
(3)地壳中含量最多的元素在元素周期表中的位置是___________ 。
(4)写出Na的原子结构示意图___________ 。
(5)主要用来制作高纯半导体、耐高温材料、光导纤维通信材料的元素名称是___________ 。
(6)卤族元素之一,属周期系VIIA族,在元素周期表中位于第二周期的元素是___________ 。
(7)O2与S单质相比,更难与H2化合的是___________ 。
(8)写出N元素的气态氢化物的化学式___________ ,该物质与水反应的化学方程式:___________ 。
(9)Cl2与水反应的生成物中具有漂白作用的是___________ (填化学式),写出Cl2与NaOH溶液反应的离子方程式:___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | X | N | O | F | Y | |||
| 3 | Na | Z | Al | Si | S | Cl |
(2)表中元素化学性质最稳定的是
(3)地壳中含量最多的元素在元素周期表中的位置是
(4)写出Na的原子结构示意图
(5)主要用来制作高纯半导体、耐高温材料、光导纤维通信材料的元素名称是
(6)卤族元素之一,属周期系VIIA族,在元素周期表中位于第二周期的元素是
(7)O2与S单质相比,更难与H2化合的是
(8)写出N元素的气态氢化物的化学式
(9)Cl2与水反应的生成物中具有漂白作用的是
您最近一年使用:0次
10 . A、B、C、D、E、F是原子序数依次增大的前四周期元素,A元素电子只有一种自旋取向;B元素原子的价电子排布是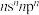 ,C是地壳中含量最多的非金属元素;
,C是地壳中含量最多的非金属元素;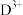 第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。
第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。
请回答:
(1)A是_______ 区的元素,BC元素形成的双原子分子结构与 相似,写出该双原子分子的电子式
相似,写出该双原子分子的电子式_______ 。
(2)C、D、E的简单离子的半径从大到小的顺序_______ (用离子符号表示)。
(3)F元素有两种常见的价态,比较这两种价态阳离子的稳定性
_______  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_______ 。
(4)与D元素成“对角线规则”关系的某短周期元素的最高价氧化物对应的水化物具有两性,写出该两性物质与E元素的最高价氧化物对应的水化物反应的化学方程式_______ 。
(5)物质X由ABC三种元素构成。按下图实验装置(部分装置略)对X进行元素分析:

①依次点燃煤气灯_______ →_______ ,进行实验。实验过程中CuO的作用是_______ (举1例,用化学方程式表示)。
②若样品X质量为2.36g,实验结束后,c管增重1.08g,d管增重3.52g。质谱测得该有机物的相对分子量为118,其分子式为_______ 。
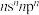 ,C是地壳中含量最多的非金属元素;
,C是地壳中含量最多的非金属元素;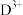 第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。
第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。请回答:
(1)A是
 相似,写出该双原子分子的电子式
相似,写出该双原子分子的电子式(2)C、D、E的简单离子的半径从大到小的顺序
(3)F元素有两种常见的价态,比较这两种价态阳离子的稳定性

 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是(4)与D元素成“对角线规则”关系的某短周期元素的最高价氧化物对应的水化物具有两性,写出该两性物质与E元素的最高价氧化物对应的水化物反应的化学方程式
(5)物质X由ABC三种元素构成。按下图实验装置(部分装置略)对X进行元素分析:

①依次点燃煤气灯
②若样品X质量为2.36g,实验结束后,c管增重1.08g,d管增重3.52g。质谱测得该有机物的相对分子量为118,其分子式为
您最近一年使用:0次



