名校
解题方法
1 . 水合肼(N2H4•H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如图图甲所示(部分夹持装置已省略)
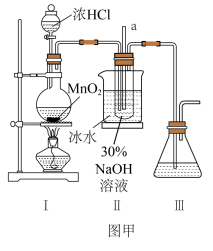
已知:3NaClO 2NaCL+NaClO3
2NaCL+NaClO3
(1)装置I中装浓盐酸的装置名称为______ ;装置I圆底烧瓶中发生的化学方程式是_______ 。
(2)II中用冰水浴控制温度在30℃以下,其主要目的________ ;NaClO的电子式为______ 。
【制取水合肼】实验装置如图乙所示
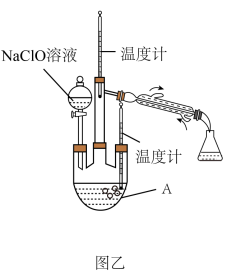
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4•H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出产率降低的相关化学反应方程式_________ ;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.300g,加水配成20.0mL溶液,一定条件下用0.150mol•L-1的I2溶液滴定。已知:N2H4•H2O+2I2=N2+4HI+H2O。
①滴定时,可以选用的指示剂为______ ;滴定终点的现象为_______ 。
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4•H2O的质量分数为______ (保留三位有效数字)。
【制备NaClO溶液】实验装置如图图甲所示(部分夹持装置已省略)

已知:3NaClO
 2NaCL+NaClO3
2NaCL+NaClO3(1)装置I中装浓盐酸的装置名称为
(2)II中用冰水浴控制温度在30℃以下,其主要目的
【制取水合肼】实验装置如图乙所示

(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4•H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出产率降低的相关化学反应方程式
【测定肼的含量】
(4)称取馏分0.300g,加水配成20.0mL溶液,一定条件下用0.150mol•L-1的I2溶液滴定。已知:N2H4•H2O+2I2=N2+4HI+H2O。
①滴定时,可以选用的指示剂为
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4•H2O的质量分数为
您最近半年使用:0次
解题方法
2 . 粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量较多的SiO2。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反应方程式:Al6Si2O13+3Na2CO3=2NaAlSiO4+4NaAlO2+3CO2↑,结合上述反应完成填空:
(1)Na2CO3中所含化学键的类型是______ ,SiO2属于______ 晶体。
(2)在上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是______ 。
(3)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为______ 。(用元素符号表示)。
(4)二氧化碳分子的结构式为_______ 。
(5)上述元素中有两种元素位于同一主族,可以作为判断两者非金属性强弱的依据的是_____ (填编号)。
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度
(1)Na2CO3中所含化学键的类型是
(2)在上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是
(3)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为
(4)二氧化碳分子的结构式为
(5)上述元素中有两种元素位于同一主族,可以作为判断两者非金属性强弱的依据的是
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度
您最近半年使用:0次
名校
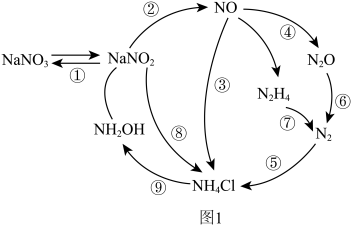
3 . 近年来,人们对微生物的氮转化进行了深入研究,将其归纳为如图1所示过程。请回答下列问题:
(1)N2的电子式为_____ ;羟胺(NH2OH)的结构式为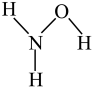 ,属于
,属于_____ (填“离子”或“共价”)化合物。
(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:_____ 。
(3)图1转化过程中具有固氮功能的是_____ (填标号)。
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。
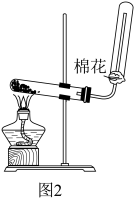
I.写出该反应的化学方程式:_____ 。
Ⅱ.棉花的作用为_____ 。
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。
I.请配平该离子方程式:_____ 。
Ⅱ.NaNO2的质量分数为_____ %。

(1)N2的电子式为
 ,属于
,属于(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:
(3)图1转化过程中具有固氮功能的是
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。

I.写出该反应的化学方程式:
Ⅱ.棉花的作用为
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO
 +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。I.请配平该离子方程式:
Ⅱ.NaNO2的质量分数为
您最近半年使用:0次
2023-04-18更新
|
400次组卷
|
3卷引用:辽宁省部分学校联考2022-2023学年高一下学期4月月考化学试题
名校
4 . 碘化钠在有机合成、医疗及食品等方面用途广泛,有多种制备方法,下图是“水合肼还原法”制备碘化钠的一种方案。

已知:①3I 2+ 6NaOH =5NaI+ NaIO3 + 3H2O。
②水合肼(N2H4·H2O)有还原性,沸点118°C,100°C开始分解。
回答下列问题:
(1)装置图中仪器a的名称为___________ 。若要使分液漏斗中的水合肼顺利流入三颈烧瓶中,具体的操作是___________ 。
(2)实验过程中需控制反应温度在70°C左右,原因是___________ 。装置图中加热的方式最好选用___________ 。
(3)肼(N2H4)的电子式为___________ 。制备过程中,N2H4· H2O参与反应的离子方程式为___________ 。工业上也可用其他方法制备NaI,但“水合肼还原法”的优点是___________ 。
(4)测定产品中NaI的含量,采用电位滴定法测定,实验步骤如下:

产品中NaI的质量分数是___________ 。

已知:①3I 2+ 6NaOH =5NaI+ NaIO3 + 3H2O。
②水合肼(N2H4·H2O)有还原性,沸点118°C,100°C开始分解。
回答下列问题:
(1)装置图中仪器a的名称为
(2)实验过程中需控制反应温度在70°C左右,原因是
(3)肼(N2H4)的电子式为
(4)测定产品中NaI的含量,采用电位滴定法测定,实验步骤如下:

产品中NaI的质量分数是
您最近半年使用:0次
名校
5 . 从氧化锌烟尘(主要成分ZnO、 、ZnS、
、ZnS、 、CaO、FeO)中提取金属锗的流程如下所示:
、CaO、FeO)中提取金属锗的流程如下所示:
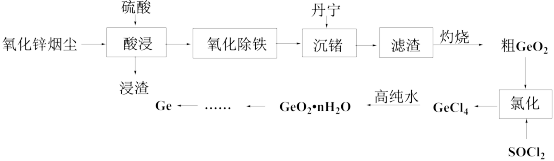
(1)写出锗的原子结构示意图:___________ 。
(2)烟尘经硫酸浸取后所得浸渣经分析含有S、 、
、___________ (填化学式),写出酸浸过程中生成S所发生的化学反应方程式:___________ 。
(3)“氧化除铁”一般先加入稍过量的氧化剂,再调节pH,当 开始沉淀时
开始沉淀时 浓度为
浓度为___________ 。
(4)“灼烧”得到粗 所需要的陶瓷仪器有
所需要的陶瓷仪器有___________ 、___________ 。
(5)“氯化”过程中除生成 外还得到一种氧化物,写出化学反应方程式:
外还得到一种氧化物,写出化学反应方程式:___________ 。
(6)用高纯水处理 后需要洗涤,能否使用pH试纸来检验
后需要洗涤,能否使用pH试纸来检验 是否洗涤干净,并说明理由:
是否洗涤干净,并说明理由:___________ 。
(7)若烟尘气中锗含量表示为 的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为___________ %。(用上述字母的代数式表示)
 、ZnS、
、ZnS、 、CaO、FeO)中提取金属锗的流程如下所示:
、CaO、FeO)中提取金属锗的流程如下所示:
(1)写出锗的原子结构示意图:
(2)烟尘经硫酸浸取后所得浸渣经分析含有S、
 、
、(3)“氧化除铁”一般先加入稍过量的氧化剂,再调节pH,当
 开始沉淀时
开始沉淀时 浓度为
浓度为| 离子沉淀相关pH |  |  |  |
开始沉淀(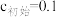 mol/L) mol/L) | 7.5 | 1.7 | 8.2 |
完全沉淀(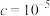 mol/L) mol/L) | 9.0 | 3.1 |
 所需要的陶瓷仪器有
所需要的陶瓷仪器有(5)“氯化”过程中除生成
 外还得到一种氧化物,写出化学反应方程式:
外还得到一种氧化物,写出化学反应方程式:(6)用高纯水处理
 后需要洗涤,能否使用pH试纸来检验
后需要洗涤,能否使用pH试纸来检验 是否洗涤干净,并说明理由:
是否洗涤干净,并说明理由:(7)若烟尘气中锗含量表示为
 的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
您最近半年使用:0次
2021-11-19更新
|
292次组卷
|
2卷引用:四川省成都市石室中学2021-2022学年高三上学期期中考试化学试题
6 . Ⅰ. 化学家侯德榜创立了中国的制碱工艺,促进了世界制碱技术的发展。下图是纯碱工艺的简化流程:
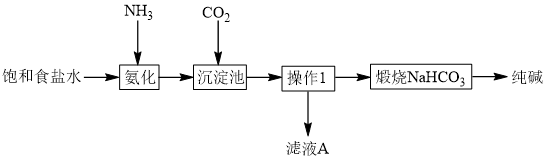
(1)写出 的电子式
的电子式_______ ,操作1的名称是_______ 。
(2)用离子方程式表示纯碱工艺中 的生成
的生成_______ 。
(3)滤液 中最主要的两种离子是
中最主要的两种离子是_______ 、_______ 。
(4)某纯碱样品因煅烧不充分而含少量 ,取质量为
,取质量为 的纯碱样品,充分加热后质量为
的纯碱样品,充分加热后质量为 ,则此样品中碳酸氢钠的质量分数为
,则此样品中碳酸氢钠的质量分数为_______ 。
Ⅱ. 医学上常用酸性高锰酸钾溶液与草酸溶液的反应来测定血钙的含量。
(5)配平以下离子方程式并填上合适的微粒:_______ 。
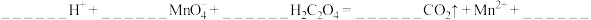
(6)测定血钙的含量取 血液用蒸馏水稀释后,向其中加入足量
血液用蒸馏水稀释后,向其中加入足量 溶液,反应生成
溶液,反应生成 沉淀,过滤并洗涤沉淀,将沉淀用豨硫酸溶解得到
沉淀,过滤并洗涤沉淀,将沉淀用豨硫酸溶解得到 后,再与定量的
后,再与定量的 溶液恰好完全反应。溶解沉淀时
溶液恰好完全反应。溶解沉淀时_______ (填“能”或“不能”)使用稀盐酸。
(7)上述实验中若消耗了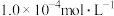 的
的 溶液
溶液 ,则
,则 该血液中含钙
该血液中含钙_______  。
。

(1)写出
 的电子式
的电子式(2)用离子方程式表示纯碱工艺中
 的生成
的生成(3)滤液
 中最主要的两种离子是
中最主要的两种离子是(4)某纯碱样品因煅烧不充分而含少量
 ,取质量为
,取质量为 的纯碱样品,充分加热后质量为
的纯碱样品,充分加热后质量为 ,则此样品中碳酸氢钠的质量分数为
,则此样品中碳酸氢钠的质量分数为Ⅱ. 医学上常用酸性高锰酸钾溶液与草酸溶液的反应来测定血钙的含量。
(5)配平以下离子方程式并填上合适的微粒:
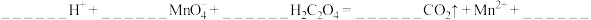
(6)测定血钙的含量取
 血液用蒸馏水稀释后,向其中加入足量
血液用蒸馏水稀释后,向其中加入足量 溶液,反应生成
溶液,反应生成 沉淀,过滤并洗涤沉淀,将沉淀用豨硫酸溶解得到
沉淀,过滤并洗涤沉淀,将沉淀用豨硫酸溶解得到 后,再与定量的
后,再与定量的 溶液恰好完全反应。溶解沉淀时
溶液恰好完全反应。溶解沉淀时(7)上述实验中若消耗了
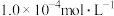 的
的 溶液
溶液 ,则
,则 该血液中含钙
该血液中含钙 。
。
您最近半年使用:0次
2019高三·全国·专题练习
解题方法
7 . 无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
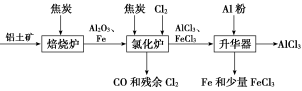
已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)Cl2的电子式________ 。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________ ;炉气中残余的少量Cl2,可用NaOH溶液吸收,其离子方程式为_____________________________________ 。
(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________ 。
a.低于183 ℃ b.介于183 ℃和315 ℃之间
c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品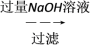 NaAlO2溶液
NaAlO2溶液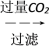 Al(OH)3
Al(OH)3 n克Al2O3
n克Al2O3
计算该样品中AlCl3的质量分数________ (结果用m、n表示,不必化简)。

已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)Cl2的电子式
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为
(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围
a.低于183 ℃ b.介于183 ℃和315 ℃之间
c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品
 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 n克Al2O3
n克Al2O3计算该样品中AlCl3的质量分数
您最近半年使用:0次
8 . A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系 (反应物和产物中的H2O已略去):
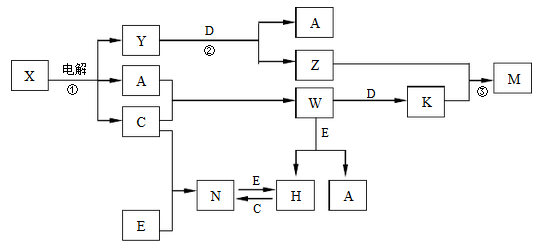
(1)Y的电子式为____________ ,构成E单质的元素在周期表中的位置_____________ 。
(2)反应②的离子方程式为_____________________ 。
(3)足量C通入Y的溶液中可得到一种常见的消毒剂。在该消毒剂中通入少量CO2可得一种酸式盐,从酸性强弱角度请你写出得到的结论:_______________________ 。
(4)①写出检验N中阳离子常用的试剂名称___________________ ,N也可用来净水,请写出相关离子方程式________________________ 。
②H的溶液在空气中久置,会变浑浊,请写出相关离子方程式_____________
(5)C可用来制取漂白粉,为测定漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为_____________ (不考虑生成CaSO4):
静置。待完全反应后,用1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为__________ (保留到小数点后两位)。

(1)Y的电子式为
(2)反应②的离子方程式为
(3)足量C通入Y的溶液中可得到一种常见的消毒剂。在该消毒剂中通入少量CO2可得一种酸式盐,从酸性强弱角度请你写出得到的结论:
(4)①写出检验N中阳离子常用的试剂名称
②H的溶液在空气中久置,会变浑浊,请写出相关离子方程式
(5)C可用来制取漂白粉,为测定漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为
静置。待完全反应后,用1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为
您最近半年使用:0次
13-14高三·全国·课时练习
名校
解题方法
9 . 位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:_________ 、_________ 、_________ 。
(2)写出含B元素质量分数最高的化合物的电子式:_____________ 。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式:______________________ 。
(4)用电子式表示化合物C2B的形成过程:__________________ 。
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:
(2)写出含B元素质量分数最高的化合物的电子式:
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式:
(4)用电子式表示化合物C2B的形成过程:
您最近半年使用:0次
2016-12-09更新
|
167次组卷
|
3卷引用:2014年高考化学一轮复习课后规范训练5-2练习卷
10 . 按照要求回答问题。
(1) 的电子式为
的电子式为_______ ,写出其用于呼吸面具做供氧剂的化学方程式:_______ 。
(2)实验室用NaOH浓溶液配制0.1 mol·L NaOH溶液500 mL,需量取密度为1.4 g·cm
NaOH溶液500 mL,需量取密度为1.4 g·cm 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液_______ mL(保留一位小数),该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管、烧杯之外,还有_______ 。
(3)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的 ,则C→D的化学方程式:
,则C→D的化学方程式:_______ 。 )是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用
)是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用 的反应原理来制备高铁酸钠,若制备1 mol
的反应原理来制备高铁酸钠,若制备1 mol  ,则该反应转移的电子为
,则该反应转移的电子为_______ mol。
(1)
 的电子式为
的电子式为(2)实验室用NaOH浓溶液配制0.1 mol·L
 NaOH溶液500 mL,需量取密度为1.4 g·cm
NaOH溶液500 mL,需量取密度为1.4 g·cm 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液(3)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的
 ,则C→D的化学方程式:
,则C→D的化学方程式:
 )是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用
)是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用 的反应原理来制备高铁酸钠,若制备1 mol
的反应原理来制备高铁酸钠,若制备1 mol  ,则该反应转移的电子为
,则该反应转移的电子为
您最近半年使用:0次



