名校
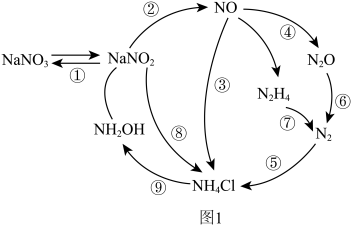
1 . 近年来,人们对微生物的氮转化进行了深入研究,将其归纳为如图1所示过程。请回答下列问题:
(1)N2的电子式为_____ ;羟胺(NH2OH)的结构式为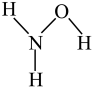 ,属于
,属于_____ (填“离子”或“共价”)化合物。
(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:_____ 。
(3)图1转化过程中具有固氮功能的是_____ (填标号)。
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。
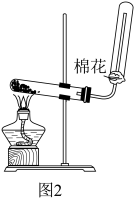
I.写出该反应的化学方程式:_____ 。
Ⅱ.棉花的作用为_____ 。
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。
I.请配平该离子方程式:_____ 。
Ⅱ.NaNO2的质量分数为_____ %。

(1)N2的电子式为
 ,属于
,属于(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:
(3)图1转化过程中具有固氮功能的是
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。

I.写出该反应的化学方程式:
Ⅱ.棉花的作用为
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO
 +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。I.请配平该离子方程式:
Ⅱ.NaNO2的质量分数为
您最近一年使用:0次
2023-04-18更新
|
402次组卷
|
3卷引用:辽宁省部分学校联考2022-2023学年高一下学期4月月考化学试题
名校
2 . 从氧化锌烟尘(主要成分ZnO、 、ZnS、
、ZnS、 、CaO、FeO)中提取金属锗的流程如下所示:
、CaO、FeO)中提取金属锗的流程如下所示:
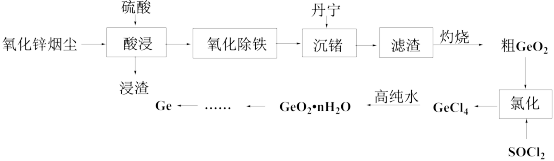
(1)写出锗的原子结构示意图:___________ 。
(2)烟尘经硫酸浸取后所得浸渣经分析含有S、 、
、___________ (填化学式),写出酸浸过程中生成S所发生的化学反应方程式:___________ 。
(3)“氧化除铁”一般先加入稍过量的氧化剂,再调节pH,当 开始沉淀时
开始沉淀时 浓度为
浓度为___________ 。
(4)“灼烧”得到粗 所需要的陶瓷仪器有
所需要的陶瓷仪器有___________ 、___________ 。
(5)“氯化”过程中除生成 外还得到一种氧化物,写出化学反应方程式:
外还得到一种氧化物,写出化学反应方程式:___________ 。
(6)用高纯水处理 后需要洗涤,能否使用pH试纸来检验
后需要洗涤,能否使用pH试纸来检验 是否洗涤干净,并说明理由:
是否洗涤干净,并说明理由:___________ 。
(7)若烟尘气中锗含量表示为 的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为___________ %。(用上述字母的代数式表示)
 、ZnS、
、ZnS、 、CaO、FeO)中提取金属锗的流程如下所示:
、CaO、FeO)中提取金属锗的流程如下所示:
(1)写出锗的原子结构示意图:
(2)烟尘经硫酸浸取后所得浸渣经分析含有S、
 、
、(3)“氧化除铁”一般先加入稍过量的氧化剂,再调节pH,当
 开始沉淀时
开始沉淀时 浓度为
浓度为| 离子沉淀相关pH |  |  |  |
开始沉淀(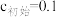 mol/L) mol/L) | 7.5 | 1.7 | 8.2 |
完全沉淀(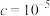 mol/L) mol/L) | 9.0 | 3.1 |
 所需要的陶瓷仪器有
所需要的陶瓷仪器有(5)“氯化”过程中除生成
 外还得到一种氧化物,写出化学反应方程式:
外还得到一种氧化物,写出化学反应方程式:(6)用高纯水处理
 后需要洗涤,能否使用pH试纸来检验
后需要洗涤,能否使用pH试纸来检验 是否洗涤干净,并说明理由:
是否洗涤干净,并说明理由:(7)若烟尘气中锗含量表示为
 的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
您最近一年使用:0次
2021-11-19更新
|
292次组卷
|
2卷引用:四川省成都市石室中学2021-2022学年高三上学期期中考试化学试题
名校
3 . 下列各图均能表示某种分子的结构,按要求回答下列问题。__________ 模型,其电子式是________________ 。
(2)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________ ,空间构型为________ 。
(3)写出上述中A、E的分子式和结构简式:A.________ ;________________ ; E.________ ;_________________ ;
(4)B中共平面的原子最多有_______ 个,F中共一条直线的原子最多有_______ 个,
(5)互为同系物的是_______ 。互为同分异构体的是_______ 。(填序号)
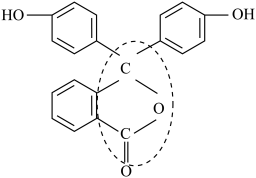
(6)酚酞是常用的酸碱指示剂,其结构简式如图所示:
A.  B.
B.  C.
C.  D.
D.  E.
E.  F.
F. 
(2)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为
(3)写出上述中A、E的分子式和结构简式:A.
(4)B中共平面的原子最多有
(5)互为同系物的是
(6)酚酞是常用的酸碱指示剂,其结构简式如图所示:
| A.烯烃 | B.芳香化合物 | C.醚类物质 | D.酯类物质 |
您最近一年使用:0次
解题方法
4 .  广泛用于冶金、化工行业,可制取多种含钒化合物。
广泛用于冶金、化工行业,可制取多种含钒化合物。
(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下: ,反应的化学方程式为
,反应的化学方程式为___________ ;若不加 ,HCl也能还原
,HCl也能还原 生成
生成 和
和 ,分析反应中不生成
,分析反应中不生成 的原因
的原因___________ 。
(2)对制得的晶体进行含钒量的测定:称取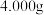 样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为
样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为 溶液;量取
溶液;量取 溶液,加入指示剂,用
溶液,加入指示剂,用 的
的 标准溶液滴定至终点,滴定过程中反应为
标准溶液滴定至终点,滴定过程中反应为 ;平行滴定4次,消耗标准溶液的体积分别为
;平行滴定4次,消耗标准溶液的体积分别为 ,则样品中钒元素的质量分数为
,则样品中钒元素的质量分数为___________ (写出计算过程,结果保留两位小数)。
(3) 时,将氧钒碱式碳酸铵晶体与
时,将氧钒碱式碳酸铵晶体与 反应制备共价晶体
反应制备共价晶体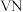 ,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是
,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是___________ 。
(4) 可溶于强酸强碱,不同
可溶于强酸强碱,不同 、不同钒元素浓度时,
、不同钒元素浓度时, 价
价 存在形态如题图所示:
存在形态如题图所示: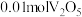 溶解在
溶解在 烧碱溶液中,剩余溶液的
烧碱溶液中,剩余溶液的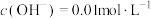 ,反应的离子方程式为
,反应的离子方程式为___________ 。
② 具有对称结构,其结构式可表示为
具有对称结构,其结构式可表示为___________ 。
 广泛用于冶金、化工行业,可制取多种含钒化合物。
广泛用于冶金、化工行业,可制取多种含钒化合物。(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
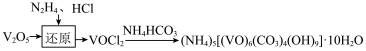
 ,反应的化学方程式为
,反应的化学方程式为 ,HCl也能还原
,HCl也能还原 生成
生成 和
和 ,分析反应中不生成
,分析反应中不生成 的原因
的原因(2)对制得的晶体进行含钒量的测定:称取
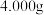 样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为
样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为 溶液;量取
溶液;量取 溶液,加入指示剂,用
溶液,加入指示剂,用 的
的 标准溶液滴定至终点,滴定过程中反应为
标准溶液滴定至终点,滴定过程中反应为 ;平行滴定4次,消耗标准溶液的体积分别为
;平行滴定4次,消耗标准溶液的体积分别为 ,则样品中钒元素的质量分数为
,则样品中钒元素的质量分数为(3)
 时,将氧钒碱式碳酸铵晶体与
时,将氧钒碱式碳酸铵晶体与 反应制备共价晶体
反应制备共价晶体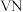 ,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是
,一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是(4)
 可溶于强酸强碱,不同
可溶于强酸强碱,不同 、不同钒元素浓度时,
、不同钒元素浓度时, 价
价 存在形态如题图所示:
存在形态如题图所示:
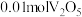 溶解在
溶解在 烧碱溶液中,剩余溶液的
烧碱溶液中,剩余溶液的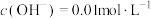 ,反应的离子方程式为
,反应的离子方程式为②
 具有对称结构,其结构式可表示为
具有对称结构,其结构式可表示为
您最近一年使用:0次
名校
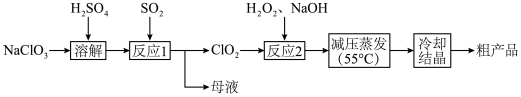
5 . 亚氯酸钠( )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L 溶液,现进行溶液配制。
溶液,现进行溶液配制。
①实验室购买的浓硫酸标签如图所示。配制所需的 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有___________ ,需要量取的浓硫酸的体积是___________ mL。
②在容量瓶的使用方法中,下列操作正确的是___________ 。
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中
③配制过程中下列各项操作可能导致浓度偏小的有___________ (填写字母)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是___________ 。
(3)“反应2”中加入的 的电子式是
的电子式是___________ ,发生反应的离子方程式是___________ 。
 )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L
 溶液,现进行溶液配制。
溶液,现进行溶液配制。①实验室购买的浓硫酸标签如图所示。配制所需的
 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有| 硫酸化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的
 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中③配制过程中下列各项操作可能导致浓度偏小的有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是
(3)“反应2”中加入的
 的电子式是
的电子式是
您最近一年使用:0次
名校
6 . 下列说法正确的是
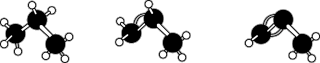

| A.丙烷、丙烯、丙炔的球棍模型分别为如图 |
| B.有机物中碳的质量分数最高的物质是乙炔 |
| C.卤代烃均难溶于水,且密度比水大 |
| D.利用溴水可以区分乙醇、己烯、四氯化碳、己烷 |
您最近一年使用:0次
解题方法
7 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。由镍矿渣[主要含 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图:

已知: 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在:
(1)“酸浸”过程中,生成了一中臭鸡蛋气味的气体,写出相应反应的离子方程式_______ ,滤渣1的主要成分是_______
(2)已知“除铁”时,NaClO的作用是将 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式_______
(3)“除钙”时,加入 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式_______
(4)若已知萃取剂的密度大于水的密度,则应保留_______ 液体。(填“上层”或“下层”)在完成“萃取”操作后,后续操作依次为_______ 、_______
(5)某化学实验小组同学模拟上述工艺流程,称取了11.8g“镍矿渣”,在实验室制备草酸镍晶体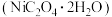 。若“沉镍”操作获得的草酸镍晶体经洗涤、干燥后,称量其质量为3.66g,则镍矿渣中镍元素的质量分数为
。若“沉镍”操作获得的草酸镍晶体经洗涤、干燥后,称量其质量为3.66g,则镍矿渣中镍元素的质量分数为_______ 。
 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图:
已知:
 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: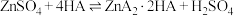
(1)“酸浸”过程中,生成了一中臭鸡蛋气味的气体,写出相应反应的离子方程式
(2)已知“除铁”时,NaClO的作用是将
 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式(3)“除钙”时,加入
 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式(4)若已知萃取剂的密度大于水的密度,则应保留
(5)某化学实验小组同学模拟上述工艺流程,称取了11.8g“镍矿渣”,在实验室制备草酸镍晶体
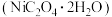 。若“沉镍”操作获得的草酸镍晶体经洗涤、干燥后,称量其质量为3.66g,则镍矿渣中镍元素的质量分数为
。若“沉镍”操作获得的草酸镍晶体经洗涤、干燥后,称量其质量为3.66g,则镍矿渣中镍元素的质量分数为
您最近一年使用:0次
名校
8 . 按照要求回答问题。
(1) 的电子式为
的电子式为_______ ,写出其用于呼吸面具做供氧剂的化学方程式:_______ 。
(2)实验室用NaOH浓溶液配制0.1 mol·L NaOH溶液500 mL,需量取密度为1.4 g·cm
NaOH溶液500 mL,需量取密度为1.4 g·cm 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液_______ mL(保留一位小数),该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管、烧杯之外,还有_______ 。
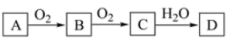
(3)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的 ,则C→D的化学方程式:
,则C→D的化学方程式:_______ 。
(4)盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):_______ 。
(5)高铁酸钠( )是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用
)是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用 的反应原理来制备高铁酸钠,若制备1 mol
的反应原理来制备高铁酸钠,若制备1 mol  ,则该反应转移的电子为
,则该反应转移的电子为_______ mol。
(1)
 的电子式为
的电子式为(2)实验室用NaOH浓溶液配制0.1 mol·L
 NaOH溶液500 mL,需量取密度为1.4 g·cm
NaOH溶液500 mL,需量取密度为1.4 g·cm 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液(3)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的
 ,则C→D的化学方程式:
,则C→D的化学方程式:
(4)盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):
(5)高铁酸钠(
 )是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用
)是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组利用 的反应原理来制备高铁酸钠,若制备1 mol
的反应原理来制备高铁酸钠,若制备1 mol  ,则该反应转移的电子为
,则该反应转移的电子为
您最近一年使用:0次
解题方法
9 . 我国化学家侯德榜改革国外的纯碱生产工艺,生产流程示意简图如下:
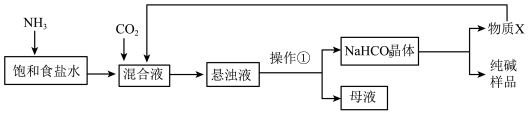
(1)物质X的电子式为_______ ;
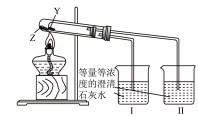
(2)上述转化过程可证明热稳定性:NaHCO3_______ Na2CO3(填“>”、“=”或“<”);如图装置也可比较二者的稳定性,则Z为_______ (填物质名称),烧杯_______ (填“I”或“II”)中溶液变浑浊。
(3)“操作①”得到的NaHCO3晶体中会含有少量NaCl杂质。
①检验含有该杂质的操作为_______ 。
②采用如下方法进行NaHCO3晶体纯度测定:

该试样中NaHCO3的质量分数为_______ %(精确到0.1)。

(1)物质X的电子式为
(2)上述转化过程可证明热稳定性:NaHCO3

(3)“操作①”得到的NaHCO3晶体中会含有少量NaCl杂质。
①检验含有该杂质的操作为
②采用如下方法进行NaHCO3晶体纯度测定:

该试样中NaHCO3的质量分数为
您最近一年使用:0次
2023-02-14更新
|
317次组卷
|
3卷引用:山东省聊城市2022-2023学年高一上学期期末教学质量抽测化学试题
山东省聊城市2022-2023学年高一上学期期末教学质量抽测化学试题山东省聊城市2022-2023学年高一上学期期末考试化学试题(已下线)专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
10 . 近日,西湖大学理学院何睿华课题组发现了世界首例具有本征相于性的光阴极量子材料——钛酸锶。某小组以钛铁矿为原料制备钛酸锶的流程图如下:

已知几种物质的主要成分如表所示。
回答下列问题:
(1)“气体”分子的电子式为_______ 。
(2)为了提高“焙烧”速率,宜采取的措施有_______ 答一条合理措施即可)。从“滤渣2”中提纯铁粉的物理方法是_______ 。
(3)“滤液2”和“滤液3”中浓度有明显变化的离子为_______ (填离子符号)。设计简单实验检验滤液4含有Fe2+:_______ 。
(4)“热解”中主要反应的离子方程式为_______ 。用“热水”而不用常温水,其目的是_______ 。
(5)在“灼烧”中盛装H2TiO3的仪器是_______ (填名称)。
(6)某钛铁矿中含钛元素的质量分数为ω,100kg该钛铁矿经上述流程最终制得mg钛酸锶,则钛的收率为_______ %(提示:钛的收率等于实际钛产量与理论钛产量之比)。

已知几种物质的主要成分如表所示。
| 物质 | 成分 |
| 钛铁矿 | 主要成分是FeTiO3,含少量SiO2、Fe3O4等 |
| 浸液1 | Fe3+、Fe2+、TiO2+、H+、 |
| 滤液2 | Fe2+、TiO2+、H+、 |
| 滤液3 | Fe2+、TiO2+、H+、 |
(1)“气体”分子的电子式为
(2)为了提高“焙烧”速率,宜采取的措施有
(3)“滤液2”和“滤液3”中浓度有明显变化的离子为
(4)“热解”中主要反应的离子方程式为
(5)在“灼烧”中盛装H2TiO3的仪器是
(6)某钛铁矿中含钛元素的质量分数为ω,100kg该钛铁矿经上述流程最终制得mg钛酸锶,则钛的收率为
您最近一年使用:0次
2023-05-01更新
|
234次组卷
|
2卷引用:江西省2023届高三下学期二模考试理综化学试题



