解题方法
1 . 如图是氮元素的几种价态与物质类别的对应关系。回答下列问题:
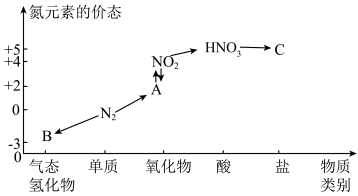
(1)写出 的一种用途:
的一种用途:___________ 。
(2)B物质的电子式为:___________ 。
(3) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为___________ 。
(4)实验室制取物质B的化学方程式为___________ 。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___________ 。
(6)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入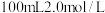 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________  。
。

(1)写出
 的一种用途:
的一种用途:(2)B物质的电子式为:
(3)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为(4)实验室制取物质B的化学方程式为
(5)浓硝酸与木炭在加热条件下反应的化学方程式为
(6)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入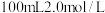 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近半年使用:0次
名校
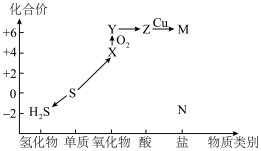
2 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系: 的电子式为
的电子式为________ ;将 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为________ 。
(2)S粉与热的Z浓溶液反应可转化为________ ,反应的化学方程式为________ 。
(3)配平下列反应:_____
____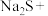 ____
____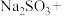 ____
____ ____
____ ____
____ ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。________ 。
②C的作用是________ ,装置D中试管口放置的棉花应浸有一种液体,这种液体是________ 。
 的电子式为
的电子式为 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为(2)S粉与热的Z浓溶液反应可转化为
(3)配平下列反应:
____
 ____
____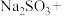 ____
____ ____
____ ____
____ ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
| A.X能使溴水褪色,证明X有漂白性 | B.将X通入 溶液中有白色沉淀生成 溶液中有白色沉淀生成 |
C.硫在过量的 中燃烧可以生成Y 中燃烧可以生成Y | D.若N为钠盐,则N与Z的稀溶液反应可生成 |
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。

②C的作用是
您最近半年使用:0次
3 . 酸碱中和反应是以水溶液为载体的反应体系中最基础、最常见的反应,其反应实质为:H++OH_H2O。在DIS数字化实验系统的应用下,我们能在电脑上采集实验数据,并绘制成直观的图像,便于我们更好地分析实验、研究课题。
I.试剂配制:配制480mL0.100mol·L-1的NaOH溶液。
(1)NaOH的电子式为___________ 。
(2)除烧杯、胶头滴管、玻璃棒以外,还需用到的玻璃仪器有________ ,在使用前,必须检查该仪器是否________ 。若用NaOH固体配置,则需用电子天平称取NaOH的质量为_________ g。
(3)下图所示是配制溶液过程中的四个步骤,回答下列问题:
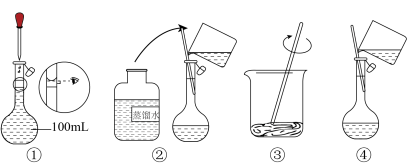
①图示四个步骤正确的先后顺序应是___________ ;
A.①②③④ B.③④②① C.③②④① D.③④①②
②步骤①为定容,在此过程中若俯视刻度线,则可能导致得到的溶液浓度___________ ;若使用的容量瓶未洗净,残留有上一次配制的相同溶液,则会导致浓度___________ 。
A.偏高 B.偏低 C.无影响
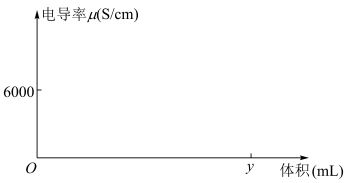
II.实验小组将电导率传感器插入40mLxmol∙L-1H2SO4溶液中,向溶液中匀速滴入I中配得的NaOH稀溶液,得到的电导率与溶液体积图像如图所示。(已知:溶液导电性越强,电导率值越大)

(4)B点曲线突然变化的原因是___________ 。
(5)根据图像,计算得到x的值为___________ 。(保留两位有效数字)
(6)小沐同学认为该图像与理论有出入:曲线AB的下降趋势应当逐渐变缓
①你是否认同这种说法?说明理由。___________
②针对实验数据与理论不符的情况,下列做法中可行的是___________ 。(不定项)
A.篡改数据,使其与理论相符
B.将实验重复多次,再进行对比分析
C.更换一套实验装置,再进行多次实验
(7)现将实验所用的酸和碱替换,使用其他种类的酸和碱再探究酸碱中和导电率与体积的对应关系。
①向0.1mol∙L-1氨水中,匀速滴入等浓度的醋酸溶液,下列图像可能正确的是___________ 。

②向ymL0.1mol∙L-1Ba(OH)2溶液中,匀速滴入等浓度的H2SO4溶液,预测曲线的变化趋势,绘制在下图中___________ 。(只需表示出变化趋势与关键点即可)
I.试剂配制:配制480mL0.100mol·L-1的NaOH溶液。
(1)NaOH的电子式为
(2)除烧杯、胶头滴管、玻璃棒以外,还需用到的玻璃仪器有
(3)下图所示是配制溶液过程中的四个步骤,回答下列问题:

①图示四个步骤正确的先后顺序应是
A.①②③④ B.③④②① C.③②④① D.③④①②
②步骤①为定容,在此过程中若俯视刻度线,则可能导致得到的溶液浓度
A.偏高 B.偏低 C.无影响
II.实验小组将电导率传感器插入40mLxmol∙L-1H2SO4溶液中,向溶液中匀速滴入I中配得的NaOH稀溶液,得到的电导率与溶液体积图像如图所示。(已知:溶液导电性越强,电导率值越大)

(4)B点曲线突然变化的原因是
(5)根据图像,计算得到x的值为
(6)小沐同学认为该图像与理论有出入:曲线AB的下降趋势应当逐渐变缓
①你是否认同这种说法?说明理由。
②针对实验数据与理论不符的情况,下列做法中可行的是
A.篡改数据,使其与理论相符
B.将实验重复多次,再进行对比分析
C.更换一套实验装置,再进行多次实验
(7)现将实验所用的酸和碱替换,使用其他种类的酸和碱再探究酸碱中和导电率与体积的对应关系。
①向0.1mol∙L-1氨水中,匀速滴入等浓度的醋酸溶液,下列图像可能正确的是

②向ymL0.1mol∙L-1Ba(OH)2溶液中,匀速滴入等浓度的H2SO4溶液,预测曲线的变化趋势,绘制在下图中

您最近半年使用:0次
名校
解题方法
4 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)硫元素在周期表中的位置为_____ ;H2S的电子式为_____ 。
(2)根据A对应的化合价和物质类别,A为_____ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_____ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_____ ,反应的离子方程式为_____ 。
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:_____ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:_____ 。

(1)硫元素在周期表中的位置为
(2)根据A对应的化合价和物质类别,A为
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的化学方程式:
您最近半年使用:0次
名校
5 . 如图是氮元素的几种价态与物质类别的对应关系。回答下列问题:
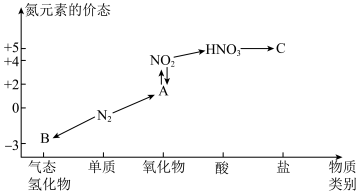
(1)B物质的电子式为:_______ 。
(2)实验室制取物质B的化学方程式为_______ 。
(3)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入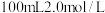 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为_______  。
。

(1)B物质的电子式为:
(2)实验室制取物质B的化学方程式为
(3)浓硝酸与木炭在加热条件下反应的化学方程式为
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入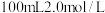 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近半年使用:0次
名校
解题方法
6 . 核外电子排布与化学键。在含有多个电子的原子例,电子的能量不同,根据电子能量的差异,电子应先排布在能量最低的电子层例,然后再依次由里向外排布在能量逐渐升高的电子层例,即分层排布。亨利·莫斯莱和查尔斯·巴克拉的X-射线吸收研究首次与实验中发现电子层。巴克拉把他们称为K、L、M、N(以英文字母排列)等电子层,这些字母后来被n值1、2、3等取代。
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是___________
(2)在1916年,G.N。Lewis在讲述他的化学键理论时提出了电子式,故电子式又被称为路易斯式。根据经典的共价键理论,在形成化合物时,原子核外的单电子要尽可能地进行配对,并达到8电子稳定结构(H为2电子稳定结构)。写出 的电子式:
的电子式:___________ 。
(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是___________
(4)化学键(chemical bond)是纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。常见的化学键有离子键和共价键。离子键是由正离子和负离子之间相互的静电作用力形成的。共价键是由两个或多个原子共同使用他们的外层电子,在理想的情况下达到电子饱和状态,由此组成比较稳定的化学结构。在下列物质中:
①Ar ②SiC ③NaCl ④ ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有___________ (填编号,下同),存在共价键的物质有___________ 。
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是___________
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是
A.硫离子的结构示意图: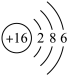 | B.钾原子的结构示意图: |
C.氯离子的电子式: | D.镁离子的电子式: |
 的电子式:
的电子式:(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是
| A.A、B、C都是非金属元素 | B.A、B、C最高价氧化物的水化物均为强酸 |
| C.A、B、C三种核电荷数之和是39 | D.B与A、C均能形成离子化合物 |
①Ar ②SiC ③NaCl ④
 ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是
| 选项 | 性质 | 解释 |
| A | 还原性: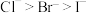 | Cl、Br、I的非金属性依次减弱 |
| B | 沸点: | N的非金属性比P强 |
| C | 分解温度: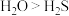 | O的非金属性比S强 |
| D | 酸性: | Cl的非金属比S强 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021高一·全国·专题练习
7 . Ⅰ.使用正确的化学用语填空。
(1)写出下列物质的电子式:
氮气___________ ;过氧化钠___________ ;四氯化碳___________ 。
(2)写出下列物质的结构式:
二氧化碳___________ ;过氧化氢___________ ;次氯酸___________ 。
Ⅱ.正确比较下列各组对应关系。
(3)已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则这四种元素:
①原子序数由大到小的顺序:___________ 。
②原子半径由大到小的顺序:___________ 。
③离子半径由大到小的顺序:___________ 。
(4)比较下列微粒半径大小,用“>”或“<”填空。
①F___________ Cl- ②Fe2+___________ Fe3+ ③O2-___________ Mg2+。
(1)写出下列物质的电子式:
氮气
(2)写出下列物质的结构式:
二氧化碳
Ⅱ.正确比较下列各组对应关系。
(3)已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则这四种元素:
①原子序数由大到小的顺序:
②原子半径由大到小的顺序:
③离子半径由大到小的顺序:
(4)比较下列微粒半径大小,用“>”或“<”填空。
①F
您最近半年使用:0次
解题方法
8 . 研究氮及其化合物的性质,可以有效改善人类的生存环境。如图是氮元素的几种价态与物质类别的对应关系。回答下列问题:
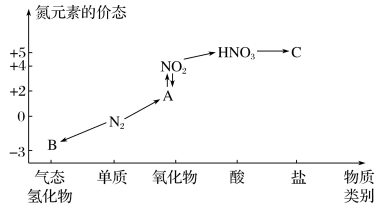
(1)写出氮气生成A的化学方程式:_______ 。
(2)物质B的电子式为_______ 。在催化剂和加热的条件下,由物质B生成物质A是工业制硝酸的重要反应,其化学方程式为_______ 。
(3) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为_______ 。
(4)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。
(5)实验室中,检验溶液中含有 的操作方法是
的操作方法是_______ 。

(1)写出氮气生成A的化学方程式:
(2)物质B的电子式为
(3)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为(4)浓硝酸与木炭在加热条件下反应的化学方程式为
(5)实验室中,检验溶液中含有
 的操作方法是
的操作方法是
您最近半年使用:0次
名校
9 . 易混易错题组
Ⅰ.使用正确的化学用语填空
(1)写出下列物质的电子式
氮气_______ 过氧化钠 _________ 四氯化碳________
(2)写出下列物质的结构式
二氧化碳________ 过氧化氢 _________ 次氯酸________
(学法题)正确书写化合物的电子式需要注意的问题是_____________
Ⅱ.正确比较下列各组对应关系
(1)已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则这四种元素:
①原子序数由大到小的顺序为:___________
②原子半径由大到小的顺序为:___________
③离子半径由大到小的顺序为:___________
(2)比较下列微粒半径大小,用“>”或“<”填空
①F-________ Cl- ②Fe2+________ Fe3+ ③O2-_________ Mg2+
(学法题)粒子半径大小比较方法(两点即可)___________
Ⅰ.使用正确的化学用语填空
(1)写出下列物质的电子式
氮气
(2)写出下列物质的结构式
二氧化碳
(学法题)正确书写化合物的电子式需要注意的问题是
Ⅱ.正确比较下列各组对应关系
(1)已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则这四种元素:
①原子序数由大到小的顺序为:
②原子半径由大到小的顺序为:
③离子半径由大到小的顺序为:
(2)比较下列微粒半径大小,用“>”或“<”填空
①F-
(学法题)粒子半径大小比较方法(两点即可)
您最近半年使用:0次
名校
10 . 短周期主族元素X、Y、Z、W、M的原子半径依次增大,与元素有关的信息如表所示:
回答下列问题:
(1) 的一种核素含有8个中子,其核素符号为
的一种核素含有8个中子,其核素符号为___________ ,写出其简单氢化物的一种用途:___________ 。
(2)由 与
与 组成的化合物含有的化学键类型为
组成的化合物含有的化学键类型为___________ 。
(3)上述元素对应的简单离子中半径最大的为___________ (填离子符号)。
(4) 单质与
单质与 的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为
的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为___________ 。
(5) 与
与 形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程
形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程___________ 。
(6) 的简单氢化物的沸点比
的简单氢化物的沸点比 的简单氢化物的沸点高,从结构角度分析其原因为
的简单氢化物的沸点高,从结构角度分析其原因为___________ 。
(7)下列关于 及
及 同主族元素的说法错误的是___________。
同主族元素的说法错误的是___________。
| 元素 | 相关信息 |
 | 简单氢化物的水溶液可以刻蚀玻璃 |
 | 最外层电子数比次外层多3 |
 | 最高正价和最低负价的代数和为4 |
 | 地壳中含量最高的金属元素 |
 | 最高价氧化物对应水化物属于强碱 |
(1)
 的一种核素含有8个中子,其核素符号为
的一种核素含有8个中子,其核素符号为(2)由
 与
与 组成的化合物含有的化学键类型为
组成的化合物含有的化学键类型为(3)上述元素对应的简单离子中半径最大的为
(4)
 单质与
单质与 的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为
的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为(5)
 与
与 形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程
形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程(6)
 的简单氢化物的沸点比
的简单氢化物的沸点比 的简单氢化物的沸点高,从结构角度分析其原因为
的简单氢化物的沸点高,从结构角度分析其原因为(7)下列关于
 及
及 同主族元素的说法错误的是___________。
同主族元素的说法错误的是___________。A.将 的单质通入其同族元素与钠形成的钠盐溶液中,可置换出同族元素的单质 的单质通入其同族元素与钠形成的钠盐溶液中,可置换出同族元素的单质 |
| B.随着原子序数递增,该主族元素对应单质的沸点逐渐升高 |
C.该主族元素中最高价氧化物对应水化物酸性最强的元素为 |
D. 的简单氢化物可与强碱溶液反应 的简单氢化物可与强碱溶液反应 |
您最近半年使用:0次



