1 . Ⅰ.氯化钠是日常生活必需品和重要的化工原料。海水中含有大量的NaCl。
(1)下列生产过程中只发生物理变化的是__________。
| A.炼铁 | B.海带提碘 | C.氯碱工业 | D.海水晒盐 |
(2)氯化钠属于__________。
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(3)
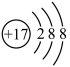 表示__________。
表示__________。| A.氯原子的结构示意图 | B.氯离子的结构示意图 |
| C.氯原子的电子式 | D.氯离子的电子式 |
Ⅱ.实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去 Ca2+、 Mg2+、 等可溶性杂质。
等可溶性杂质。
(4)写出NaCl溶于水时的电离方程式
(5)为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3液,加热至70°C左右约2分钟,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
Ⅲ.“84消毒液”是常见的消毒剂,其有效成分是NaClO。
(6)Cl2和NaOH 制备NaClO的化学方程式为
Ⅳ.如图是某品牌“84 消毒液”的使用注意事项。

(7)注意事项4“易使有色衣物脱色”,是因为 “84 消毒液”具有
A.碱性 B.强氧化性
(8)注意事项6“不可与酸性物质同时使用”,例如,若将“84 消毒液”与“洁厕灵”(含盐酸) 同时使用会产生黄绿色有毒气体。写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 核外电子排布与化学键。在含有多个电子的原子例,电子的能量不同,根据电子能量的差异,电子应先排布在能量最低的电子层例,然后再依次由里向外排布在能量逐渐升高的电子层例,即分层排布。亨利·莫斯莱和查尔斯·巴克拉的X-射线吸收研究首次与实验中发现电子层。巴克拉把他们称为K、L、M、N(以英文字母排列)等电子层,这些字母后来被n值1、2、3等取代。
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是___________
(2)在1916年,G.N。Lewis在讲述他的化学键理论时提出了电子式,故电子式又被称为路易斯式。根据经典的共价键理论,在形成化合物时,原子核外的单电子要尽可能地进行配对,并达到8电子稳定结构(H为2电子稳定结构)。写出 的电子式:
的电子式:___________ 。
(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是___________
(4)化学键(chemical bond)是纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。常见的化学键有离子键和共价键。离子键是由正离子和负离子之间相互的静电作用力形成的。共价键是由两个或多个原子共同使用他们的外层电子,在理想的情况下达到电子饱和状态,由此组成比较稳定的化学结构。在下列物质中:
①Ar ②SiC ③NaCl ④ ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有___________ (填编号,下同),存在共价键的物质有___________ 。
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是___________
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是
A.硫离子的结构示意图: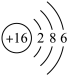 | B.钾原子的结构示意图: |
C.氯离子的电子式: | D.镁离子的电子式: |
 的电子式:
的电子式:(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是
| A.A、B、C都是非金属元素 | B.A、B、C最高价氧化物的水化物均为强酸 |
| C.A、B、C三种核电荷数之和是39 | D.B与A、C均能形成离子化合物 |
①Ar ②SiC ③NaCl ④
 ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是
| 选项 | 性质 | 解释 |
| A | 还原性: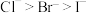 | Cl、Br、I的非金属性依次减弱 |
| B | 沸点: | N的非金属性比P强 |
| C | 分解温度: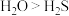 | O的非金属性比S强 |
| D | 酸性: | Cl的非金属比S强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 金属A制成金属板经加工可制成一种高质量的反光镜,该金属粉末和氧化铁混合常用于焊接钢轨;A与同周期的主族元素B的单质能形成AB3型的化合物,此化合物可作净水剂,试回答:
(1)A元素的离子结构示意图是___ ,B元素在元素周期表中位于第___ 周期第___ 族。
(2)A元素的最高价氧化物对应水化物的化学式为___ ,该物质____ (填“能”或“不能”)溶于氨水,该物质在水中的电离方程式为___ 。
(3)B元素最高价氧化物对应水化物的化学式为____ ,其酸性比硫酸酸性___ (填“强”或“弱”),写出它与氢氧化钠溶液反应的离子方程式___ 。
(4)A金属与氧化铁反应中体现了A单质的强___ (填“氧化性”或“还原性”)。
(1)A元素的离子结构示意图是
(2)A元素的最高价氧化物对应水化物的化学式为
(3)B元素最高价氧化物对应水化物的化学式为
(4)A金属与氧化铁反应中体现了A单质的强
您最近一年使用:0次
4 . 以下元素及物质与人类的生产生活紧密相关。完成下列填空:
(1)氯元素原子结构示意图为_______ ,其与钠元素组成的化合物的电子式为_______ 。
(2)铝是地壳中含量最高的金属元素,其在周期表中位于第_______ 周期_______ 族。
(3)以下不是铝和铁的共同性质的是_______ 。
a.导电性 b.导热性 c.延展性 d.两性
(4)下列能说明氯元素的非金属性比硫元素强的事实是_____ 。
a.稳定性 HCl>H2S b.氧化性 HClO>H2SO4
c.酸性HClO4>H2SO4强 d.HCl溶液是强酸,H2S溶液是弱酸
(5)氨水呈碱性,写出氨水的电离方程式。_______
(1)氯元素原子结构示意图为
(2)铝是地壳中含量最高的金属元素,其在周期表中位于第
(3)以下不是铝和铁的共同性质的是
a.导电性 b.导热性 c.延展性 d.两性
(4)下列能说明氯元素的非金属性比硫元素强的事实是
a.稳定性 HCl>H2S b.氧化性 HClO>H2SO4
c.酸性HClO4>H2SO4强 d.HCl溶液是强酸,H2S溶液是弱酸
(5)氨水呈碱性,写出氨水的电离方程式。
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分:(不得用a~h字母回答)元素周期表有7个横行,每一个横行称为“周期”,周期序数=电子层数;元素周期表共有18列,每一列称为 “族”,下表中的7列为主族元素,分别用罗马数字Ⅰ、Ⅱ、……表明族序数,族序数=最外层电子数。
根据a~h各元素的性质,选择相应的化学符号、化学式或化学方程式 填空:
(1)单质氧化性最强的是__________ ,酸性最强的含氧酸是_____________ 。
(2)写出e的碱性气态氢化物的电子式_____ ,将它和化合物df 2通入饱和食盐水发生反应的化学方程式是_____ 。
(3)最高价氧化物对应的水化物中,碱性最强的是___________ 。
(4)在b、c、g、h中,常见离子半径最大的是__________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | a | ||||||
二 | d | e | f | h | |||
三 | b | c | g |
(1)单质氧化性最强的是
(2)写出e的碱性气态氢化物的电子式
(3)最高价氧化物对应的水化物中,碱性最强的是
(4)在b、c、g、h中,常见离子半径最大的是
您最近一年使用:0次
名校
解题方法
6 . 含氮化合物种类多,用途广。回答下列问题。
(1)NH3的电子式为__________ ,NH3与NaClO在一定条件下可生成N2H4,化学方程式为__________ 。
(2) 又称联氨,为二元弱碱,不如氨气稳定,还原性强于氨气。
又称联氨,为二元弱碱,不如氨气稳定,还原性强于氨气。
①联氨在水中的电离方程式与氨相似,则联氨第一步的电离方程式为__________ 。
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是 的KOH溶液。肼空气燃料电池放电时,负极的电极反应式是
的KOH溶液。肼空气燃料电池放电时,负极的电极反应式是__________ 。
③从分子结构角度分析,N2H4不如氨气稳定的原因是__________ 。
(3)常温下,在NH4Cl溶液中加入NaOH(s)至中性,则 =
=__________ (常温下NH3·H2O的电离平衡常数为 )。
)。
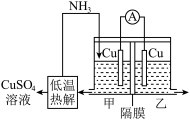
(4)利用热再生氨电池可实现CuSO4电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是__________。
(5)在加热条件下通入过量的NH3与CuO反应,可得到红色固体。设计实验验证尾气中比较活泼的两种气体__________ 。
(1)NH3的电子式为
(2)
 又称联氨,为二元弱碱,不如氨气稳定,还原性强于氨气。
又称联氨,为二元弱碱,不如氨气稳定,还原性强于氨气。①联氨在水中的电离方程式与氨相似,则联氨第一步的电离方程式为
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是
 的KOH溶液。肼空气燃料电池放电时,负极的电极反应式是
的KOH溶液。肼空气燃料电池放电时,负极的电极反应式是③从分子结构角度分析,N2H4不如氨气稳定的原因是
(3)常温下,在NH4Cl溶液中加入NaOH(s)至中性,则
 =
= )。
)。(4)利用热再生氨电池可实现CuSO4电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是__________。

| A.甲室Cu电极为负极 |
| B.Cu2+通过隔膜进入乙室 |
| C.电池总反应为:Cu2++4NH3=[Cu(NH3)4]2+ |
| D.NH3扩散到乙室不会对电池电压产生影响 |
(5)在加热条件下通入过量的NH3与CuO反应,可得到红色固体。设计实验验证尾气中比较活泼的两种气体
您最近一年使用:0次
7 . A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性。G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)ACD形成的化合物含的化学键有___________ 。
(2)D单质与C单质在加热条件下反应产物的电子式___________ ,该物质与 反应的离子方程式
反应的离子方程式___________ 。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为___________ 。
(4)E的最高价氧化物对应水合物的浓溶液在加热条件下加入过量的G单质,反应的化学方程式为___________
(5)用电子式写出 的形成过程
的形成过程___________ 。
(1)ACD形成的化合物含的化学键有
(2)D单质与C单质在加热条件下反应产物的电子式
 反应的离子方程式
反应的离子方程式(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为
(4)E的最高价氧化物对应水合物的浓溶液在加热条件下加入过量的G单质,反应的化学方程式为
(5)用电子式写出
 的形成过程
的形成过程
您最近一年使用:0次
8 . KCN为剧毒物质,含有KCN的废水可在碱性条件下用NaClO溶液将其转化为无毒物质。反应原理为 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是
 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是A.KCN的电子式为 | B.氧化产物与还原产物的物质的量之比为2∶5 |
C.每转移5 mol  ,生成标准状况下11.2L ,生成标准状况下11.2L  | D.氧化性: |
您最近一年使用:0次
9 . 过氧化氢( )被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法不正确的是
)被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法不正确的是
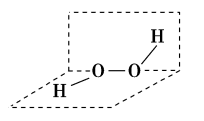
 )被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法不正确的是
)被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法不正确的是
A. 既有氧化性又有还原性 既有氧化性又有还原性 |
| B.过氧化氢分子中含有H—H键、O—O键 |
C.过氧化氢分子的电子式为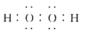 |
| D.过氧化氢分子中存在极性共价键和非极性共价键 |
您最近一年使用:0次
10 . 下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
(1)得电子能力最强的原子是___________ ;
(2)化学性质最不活泼的单质是___________ ﹔
(3)F与Cl相比,原子半径较大的是___________ ;
(4) 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是___________ ﹔
(5)原子最外层电子数与最内层电子数相等的元素是___________ ﹔
(6)某阴离子的结构示意图为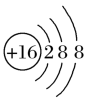 ,其离子符号是
,其离子符号是___________ ;
(7) 与
与 中,能与
中,能与 溶液反应的是
溶液反应的是___________ ﹔
(8)第三周期元素中能与冷水剧烈反应的金属单质是___________ ,写出该反应的化学方程式:___________ ;
(9)碳的一种氢化物结构式为 ,其分子式是
,其分子式是___________ ,其中碳元素与氢元素的质量比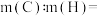
___________ ;(相对原子质量:C-12,H-1)
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填标号 )。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Mg | Al | S | Cl |
(1)得电子能力最强的原子是
(2)化学性质最不活泼的单质是
(3)F与Cl相比,原子半径较大的是
(4)
 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是(5)原子最外层电子数与最内层电子数相等的元素是
(6)某阴离子的结构示意图为
 ,其离子符号是
,其离子符号是(7)
 与
与 中,能与
中,能与 溶液反应的是
溶液反应的是(8)第三周期元素中能与冷水剧烈反应的金属单质是
(9)碳的一种氢化物结构式为
 ,其分子式是
,其分子式是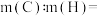
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填
A.还原性: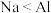 | B.非金属性: |
C.酸性: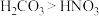 | D.碱性: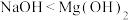 |
您最近一年使用:0次



