1 . 下表是元素周期表的一部分,针对表中的①~⑨种元素,回答下列问题:
(1)元素⑧在周期表中的位置是___________ 。
(2)表中的①~⑨种元素,其最高价氧化物对应的水化物酸性最强的含氧酸
是___________ (填化学式),上述主族元素中原子半径最大的是___________ (填化学式)。
(3)元素④与⑧的简单氢化物稳定性强的是___________ (填化学式)。
(4)钾元素与⑨形成的化合物的电子式为___________ ,该化合物是由___________ (填“离子”、“共价”)键形成的。
(5)⑤⑥⑦的金属性强弱为:___________ (用元素符号表示),⑦和⑧最高价氧化物的水化物相互反应的离子方程式为______________________
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | Ar |
(2)表中的①~⑨种元素,其最高价氧化物对应的水化物酸性最强的含氧酸
是
(3)元素④与⑧的简单氢化物稳定性强的是
(4)钾元素与⑨形成的化合物的电子式为
(5)⑤⑥⑦的金属性强弱为:
您最近一年使用:0次
2 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第4周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题。
(1)B元素基态原子具有___________ 种运动状态不同的电子,能量最高的电子,其电子云在空间有___________ 个伸 展方向。
(2)根据上述信息,画出C元素基态原子的轨道表示式___________ 。
(3)F在元素周期表中属于___________ 区元素。
(4)写出DA3的电子式:___________ (用元素符号表示)。
| 元素 | 相关信息 |
| A | 元素的原子核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 元素的第一至第四电离能分别是I1=738 kJ/mol、I2=1451 kJ/mol、I3= 7733 kJ/mol、I4= 10540 kJ/mol |
| D | 原子核外填充电子的所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为3 |
| F | 在元素周期表的第6列 |
(2)根据上述信息,画出C元素基态原子的轨道表示式
(3)F在元素周期表中属于
(4)写出DA3的电子式:
您最近一年使用:0次
解题方法
3 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)写出BA3的电子式:_________ 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有_____ 个取向,原子轨道呈___ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_____ 。
(4)比较B和D的电负性_________ >_________ (填元素符号)。
(5)G的价电子轨道排布式为_________ 。
(6)H位于_________ 族,__________ 区,该元素的核外电子排布式为__________ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G是所在周期中未成对电子最多的元素 |
| H在周期表的第七列 |
(1)写出BA3的电子式:
(2)B元素基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)比较B和D的电负性
(5)G的价电子轨道排布式为
(6)H位于
您最近一年使用:0次
解题方法
4 . 氯化钠是日常生活必需品和重要的化工原料。
(1)NaCl固体是否属于电解质?______ ,是否能导电?______ (填写“是”或“否”)。
(2)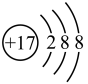 表示
表示______ 。
A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO 等可溶性杂质。
等可溶性杂质。
①写出NaCl溶于水时的电离方程式______ 。
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和______ 。
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为_______ 。
如图是某品牌“84消毒液”的使用注意事项。
②注意事项4“易使有色衣物脱色”,是因为“84消毒液”具有______ 。
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式_______ 。
(1)NaCl固体是否属于电解质?
(2)
 表示
表示A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO
 等可溶性杂质。
等可溶性杂质。①写出NaCl溶于水时的电离方程式
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为
如图是某品牌“84消毒液”的使用注意事项。
| 注意事项 1、外用消毒液,勿口服; 2、现用现配,使用时注意戴手套防护; 3、不适用于钢和铝制品的消毒; 4、易使有色衣物脱色; 5、避光、阴凉处保存; 6、不可与酸性物质同时使用. |
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式
您最近一年使用:0次
名校
5 . 如图是氮元素的几种价态与物质类别的对应关系。回答下列问题:
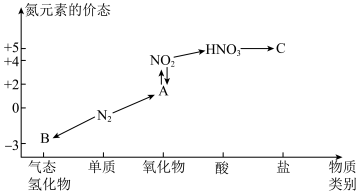
(1)B物质的电子式为:_______ 。
(2)实验室制取物质B的化学方程式为_______ 。
(3)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入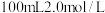 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为_______  。
。

(1)B物质的电子式为:
(2)实验室制取物质B的化学方程式为
(3)浓硝酸与木炭在加热条件下反应的化学方程式为
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入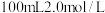 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近一年使用:0次
解题方法
6 . X 、Y 、Z 、W 、Q 、R为原子序数依次增大的短周期元素,在周期表中,X的原子半径最小,Z的主族序数是其周期数的三倍,Z与R的最外层电子数相等;Z与R的质子数之和是X与W的质子数之和两倍;Y元素的一种同位素可以用来测定文物年代;Q简单离子的半径是其所在周期中最小。请回答下列问题:
(1)Q元素在周期表中的位置是___________ ,W与R形成的化合物W2R的电子式是___________ 。
(2)Z、R的简单氢化物的沸点较高的是:___________ (填氢化物的化学式),解释原因是:___________ 。
(3)下列有关说法不正确 的是___________。
(1)Q元素在周期表中的位置是
(2)Z、R的简单氢化物的沸点较高的是:
(3)下列有关说法
| A.X与W形成的化合物属于共价化合物 |
| B.与Y同一主族的第四周期元素的原子序数为32 |
| C.X与Y形成的化合物中不可能含非极性键 |
| D.最高价氧化物对应的水化物碱性:Q<W |
您最近一年使用:0次
7 . A、B、C、D、E、F是原子序数依次增大的前四周期元素,A元素电子只有一种自旋取向;B元素原子的价电子排布是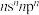 ,C是地壳中含量最多的非金属元素;
,C是地壳中含量最多的非金属元素;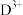 第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。
第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。
请回答:
(1)A是_______ 区的元素,BC元素形成的双原子分子结构与 相似,写出该双原子分子的电子式
相似,写出该双原子分子的电子式_______ 。
(2)C、D、E的简单离子的半径从大到小的顺序_______ (用离子符号表示)。
(3)F元素有两种常见的价态,比较这两种价态阳离子的稳定性
_______  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_______ 。
(4)与D元素成“对角线规则”关系的某短周期元素的最高价氧化物对应的水化物具有两性,写出该两性物质与E元素的最高价氧化物对应的水化物反应的化学方程式_______ 。
(5)物质X由ABC三种元素构成。按下图实验装置(部分装置略)对X进行元素分析:

①依次点燃煤气灯_______ →_______ ,进行实验。实验过程中CuO的作用是_______ (举1例,用化学方程式表示)。
②若样品X质量为2.36g,实验结束后,c管增重1.08g,d管增重3.52g。质谱测得该有机物的相对分子量为118,其分子式为_______ 。
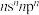 ,C是地壳中含量最多的非金属元素;
,C是地壳中含量最多的非金属元素;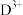 第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。
第三周期中半径最小的简单离子;E元素负一价离子的能层结构与氩相同;F元素基态原子核外有7个能级上有电子且有4个未成对电子。请回答:
(1)A是
 相似,写出该双原子分子的电子式
相似,写出该双原子分子的电子式(2)C、D、E的简单离子的半径从大到小的顺序
(3)F元素有两种常见的价态,比较这两种价态阳离子的稳定性

 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是(4)与D元素成“对角线规则”关系的某短周期元素的最高价氧化物对应的水化物具有两性,写出该两性物质与E元素的最高价氧化物对应的水化物反应的化学方程式
(5)物质X由ABC三种元素构成。按下图实验装置(部分装置略)对X进行元素分析:

①依次点燃煤气灯
②若样品X质量为2.36g,实验结束后,c管增重1.08g,d管增重3.52g。质谱测得该有机物的相对分子量为118,其分子式为
您最近一年使用:0次
8 . 利用下图,可以从不同角度研究含硫物质的性质及其转化关系,图中物质甲~己中均含有硫元素.回答下列问题:
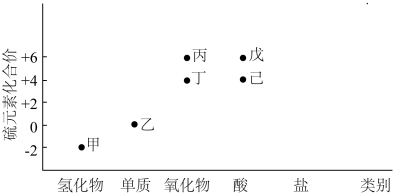
(1)写出甲的电子式:_______ ,该物质中的硫元素可表现出___________ (填“氧化性”或“还原性”);利用高温热分解甲可以获得乙,该方法的优点是______________ ,缺点是_____________ .
(2)黄铁矿(主要成分为 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是__________ (填“丙”或“丁”),该物质与水化合生成___________ (填化学名称).
(3)① 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为_______________________________ .
②同位素示踪实验可证实 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为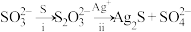 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为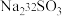 和
和 ,过程ii含硫产物是
,过程ii含硫产物是_____________ (标记出同位素原子).

(1)写出甲的电子式:
(2)黄铁矿(主要成分为
 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是(3)①
 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为②同位素示踪实验可证实
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为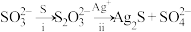 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为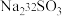 和
和 ,过程ii含硫产物是
,过程ii含硫产物是
您最近一年使用:0次
解题方法
9 . X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为 ,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为___________ ;元素Z的离子结构示意图为___________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为___________ 。
(3)元素W位于周期表的第___________ 族,其非金属性比R弱,用原子结构的知识解释原因:___________ 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:___________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
 ,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为
 ,则该反应的化学方程式为
,则该反应的化学方程式为
您最近一年使用:0次
解题方法
10 . 有A、B、C、D、E、F六种物质,它们之间的反应关系如下所示:
① ②
②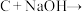 蓝色沉淀
蓝色沉淀
③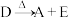 ④
④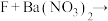 白色沉淀
白色沉淀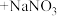 。
。
请回答下列问题。
(1)写出化学式:B_______ 、F_______ ;用电子式表示E的形成过程_______ 。
(2)写出①④反应的离子方程式:①_______ ;④_______ 。
(3)根据西汉《淮南万毕术》记载,C溶液与Fe的反应是现代湿法冶金的基础,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目,化学方程式:_______ 。
①
 ②
②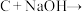 蓝色沉淀
蓝色沉淀
③
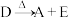 ④
④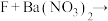 白色沉淀
白色沉淀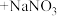 。
。请回答下列问题。
(1)写出化学式:B
(2)写出①④反应的离子方程式:①
(3)根据西汉《淮南万毕术》记载,C溶液与Fe的反应是现代湿法冶金的基础,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目,化学方程式:
您最近一年使用:0次



