名校
1 . 元素①~⑧在元素周期表中的位置如图,回答有关问题:
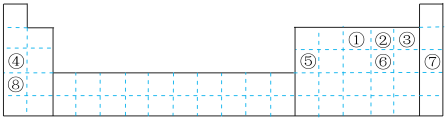
(1)画出⑥的离子结构示意图______ ;写出②含有10个中子的核素的化学符号_____ 。
(2)请写出①的氢化物发生催化氧化的化学方程式______ 。
(3)表中能形成两性氢氧化物的元素是______ (填元素符号),写出该元素的氧化物与⑧的最高价氧化物的水化物反应的离子方程式_____ 。
(4)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应______ 。

(1)画出⑥的离子结构示意图
(2)请写出①的氢化物发生催化氧化的化学方程式
(3)表中能形成两性氢氧化物的元素是
(4)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应
您最近一年使用:0次
2 . 短周期元素M、Q、P、X、Y在元素周期表中的位置如下表,已知Y的单质通常为黄绿色气体。
(1)M、Q、P、X四种元素中原子半径最小的是_______ (写元素符号);
(2)M元素在周期表中的位置_______ ,写出M的最高价氧化物的电子式_______ ,将等物质的量的M的最简单的氢化物和Y的单质混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是_______ (写分子式);
(3)Y元素的单质与水发生反应的离子方程式_______ ,Q、Y二种元素的氢化物在空气中相遇的现象是_______ ;
(4)M、X、Y三种元素的最高价氧化物对应的水化物,按酸性由强到弱的顺序排列为_______ (用化学式表示);
(5)物质丁的元素组成和P的最简单的氢化物相同,丁分子具有18电子结构,向盛有一定浓度丁溶液的试管中,加入少量二氧化锰粉末,发生反应的化学方程式_______ 。
| M | Q | P | |
| X | Y |
(2)M元素在周期表中的位置
(3)Y元素的单质与水发生反应的离子方程式
(4)M、X、Y三种元素的最高价氧化物对应的水化物,按酸性由强到弱的顺序排列为
(5)物质丁的元素组成和P的最简单的氢化物相同,丁分子具有18电子结构,向盛有一定浓度丁溶液的试管中,加入少量二氧化锰粉末,发生反应的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 氯化钠是重要的调味品,是舌尖上最不可缺少的味道。如下三幅示意图分别表示不同的化学反应,但生成物中都有氯化钠。
(1)下图是金属钠与氯气反应生成氯化钠的微观示意图。由图可知,元素的化学性质主要与原子的_______有密切的关系。

(2)下图描述了NaOH溶液与盐酸反应的微观实质,该反应的基本反应类型为_______ 反应,图中A微粒的电子式为_______ ,C微粒的结构式为_______ 。

(3)向(2)反应后的液体中滴加酚酞溶液,溶液显无色,为探究反应后溶液中是否有盐酸剩余,所选试剂错误的是_______。
(4)下图中“ ”属于
”属于_______ (选填“离子”或“共价”)化合物;下图所示反应的化学方程式为_______ 。

(5)电解饱和氯化钠溶液, 产生在电解装置的
产生在电解装置的_______ 极;检验 的方法(含操作和实验现象)是
的方法(含操作和实验现象)是_______ 。
(6)若电解饱和食盐水时,饱和食盐水混有氯化镁杂质,则电解时与电源_______ 极相连的一极会生成白色沉淀。
(1)下图是金属钠与氯气反应生成氯化钠的微观示意图。由图可知,元素的化学性质主要与原子的_______有密切的关系。

| A.最外层电子数 | B.内层电子数 | C.电子层数 | D.相对原子质量 |

(3)向(2)反应后的液体中滴加酚酞溶液,溶液显无色,为探究反应后溶液中是否有盐酸剩余,所选试剂错误的是_______。
| A.石蕊 | B.锌粒 | C.硝酸银溶液 | D.碳酸钠溶液 |
 ”属于
”属于
(5)电解饱和氯化钠溶液,
 产生在电解装置的
产生在电解装置的 的方法(含操作和实验现象)是
的方法(含操作和实验现象)是(6)若电解饱和食盐水时,饱和食盐水混有氯化镁杂质,则电解时与电源
您最近一年使用:0次
4 . A、B、C、D、E为元素周期表中前18号常见元素,原子序数按顺序增大。A的原子半径在所有元素中最小,B的最外层电子数是次外层电子数的2倍,D与E最外层电子数相等,E的最高价氧化物中含氧60%。
(1)写出E的最高价氧化物的化学式_______ ;写出C的氢化物的电子式_______ ;
(2)A2D2中存在的化学键_______ ;写出B与E形成的化合物BE2的结构式_______ 。
(3)比较C、D、E三种元素形成的简单离子的半径大小_______ (用元素离子符号表示)。
(4)1molB的单质与足量D的单质完全反应后,放出akJ的热量,写出该反应的热化学方程式_______ 。
(1)写出E的最高价氧化物的化学式
(2)A2D2中存在的化学键
(3)比较C、D、E三种元素形成的简单离子的半径大小
(4)1molB的单质与足量D的单质完全反应后,放出akJ的热量,写出该反应的热化学方程式
您最近一年使用:0次
名校
解题方法
5 . W、X、Y、Z、R、V、Q是七种短周期元素,原子序数依次增大。X原子的最外层电子数是次外层的2倍,Z为地壳中含量最多的元素,V的周期数和主族序数相等,W和R同主族,且都能与Z形成A2Z、A2Z2(A可以表示W或R)型的两种化合物,Q的单质为黄绿色有毒气体。请回答下列问题:
(1)W为____ (填元素名称),Q在元素周期表中的位置为_____ 。
(2)X和Y的气态氢化物中稳定性较强的是____ (填化学式)。
(3)写出XZ2的电子式____ 。
(4)请写出V的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物反应的离子方程式_____ 。
(1)W为
(2)X和Y的气态氢化物中稳定性较强的是
(3)写出XZ2的电子式
(4)请写出V的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物反应的离子方程式
您最近一年使用:0次
2022-08-30更新
|
103次组卷
|
2卷引用:浙江省湖州市吴兴高级中学2020-2021学年高一上学期12月月考化学试题
6 . 氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g·L-1。请回答下列问题:
(1)乙的电子式是_______ 。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是_______ 。
(3)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_______ 。
(4)甲与乙之间能发生反应产生H2,判断理由是_______ 。
(1)乙的电子式是
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是
(3)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
(4)甲与乙之间能发生反应产生H2,判断理由是
您最近一年使用:0次
7 . A和B均为钠盐的水溶液,A呈中性,B是“84”消毒液的主要成分。下述为相关实验步骤和实验现象:
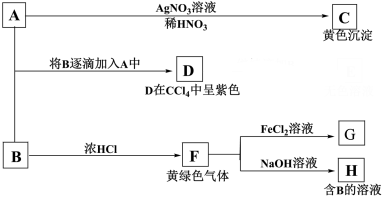
请回答:
(1)写出钠离子的结构示意图_______ 。
(2)写出B和D的化学式:B_______ D_______ 。
(3)写出由A→C反应的离子方程式_______ F→H的化学方程式_______ ,
(4)写出实验室制F的化学方程式_______ 。

请回答:
(1)写出钠离子的结构示意图
(2)写出B和D的化学式:B
(3)写出由A→C反应的离子方程式
(4)写出实验室制F的化学方程式
您最近一年使用:0次
解题方法
8 . 由两种短周期元素以原子个数比1:9组成的化合物M是一种高爆炸性物质,撞击M爆炸时发生分解反应生成气体单质A和化合物B。8.20gB与足量NaOH溶液反应,生成4.48L(标况)能使湿润的红色石蕊试纸变蓝色的气体C;所得溶液滴加稀硫酸至过量,先产生白色胶状沉淀D,后沉淀逐渐消失。请回答下列问题:
(1)气体C的电子式为_______ 。
(2)M→A+B的化学方程式为_______ 。
(3)下列说法正确的是_______
(1)气体C的电子式为
(2)M→A+B的化学方程式为
(3)下列说法正确的是_______
| A.气体A和O2在一定条件下反应生成的氧化物能形成酸雨 |
| B.化合物B与NaOH溶液反应不属于氧化还原反应 |
| C.工业制备C时宜采用高温低压,以提高反应物的转化率 |
| D.沉淀D可溶于气体C的水溶液 |
您最近一年使用:0次
名校
9 . 原子序数由小到大排列的四种短周期元素 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。
(1)写出 的电子式:
的电子式:___________ 。其中含有的化学键是___________ 。
(2)用电子式表示 的形成过程
的形成过程___________ 。
(3) 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是___________ (填化学式)。
(4) 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是___________ (填化学式)。
(5)由 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式___________ 。
 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。(1)写出
 的电子式:
的电子式:(2)用电子式表示
 的形成过程
的形成过程(3)
 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是(4)
 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是(5)由
 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
您最近一年使用:0次
2022-04-01更新
|
204次组卷
|
13卷引用:2015-2016学年江西省金溪一中高一下期中化学试卷
2015-2016学年江西省金溪一中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2016-2017学年辽宁省庄河高级中学高二上开学测化学试卷2018版化学(苏教版)高考总复习专题五课时跟踪训练--微粒之间的相互作用力与物质的多样性山西省运城市康杰中学2017-2018学年高一下学期期中考试化学试题北京四中2017-2018学年高一下学期第二次月考化学试题新疆自治区和田地区和田县喀什塔什乡中学2019届高三年级四月调研考试理综化学试题百所名校联考-必修二模块综合检测黑龙江省哈尔滨市尚志市尚志中学2021届高三10月月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题河南省新野县第一高级中学校2021-2022学年高一下学期第三次考试化学试题四川省成都市树德中学2021-2022学年高一下学期5月阶段性测试化学试题
13-14高二·全国·课时练习
名校
解题方法
10 . 有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外仅有一个非空原子轨道,也是宇宙中最丰富的元素;B元素原子核外p电子数比s电子数少1;C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道为全充满或半充满状态。
(1)写出四种元素的元素符号:A_______ ,B_______ ,C_______ ,D_______ 。
(2)写出C、D两种元素基态原子的核外电子排布图:C_______ 。D_______ 。
(3)写出B、C两种元素的单质在一定条件下反应的化学方程式:_______ 。
(4)B元素的单质的电子式为_______ ,其简单氢化物的电子式为_______ 。
(1)写出四种元素的元素符号:A
(2)写出C、D两种元素基态原子的核外电子排布图:C
(3)写出B、C两种元素的单质在一定条件下反应的化学方程式:
(4)B元素的单质的电子式为
您最近一年使用:0次
2022-03-03更新
|
194次组卷
|
14卷引用:2014学年高二鲁科选修3化学训练1.2.1基态原子核外电子排布练习卷
(已下线)2014学年高二鲁科选修3化学训练1.2.1基态原子核外电子排布练习卷(已下线)2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷(已下线)2014届新疆乌鲁木齐市兵团二中高二(上)期末化学试卷黑龙江省齐齐哈尔市第八中学2017-2018学年高二3月月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二下学期第三次月考化学试题人教化学选修3第一章第一节课时3湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题课时1 基态原子的核外电子排布——A学习区 夯实基础(鲁科版选修3)(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构 课时3 泡利原理、洪特规则和能量最低原理安徽省白泽湖中学2020-2021学年高二下学期期中考试化学试题云南省玉溪市峨山一中2021—2022学年高二下学期3月月考化学试题云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题



