名校
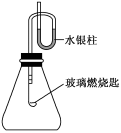
1 . 如图装配好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆)。取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管;当火焰熄灭后,静置,水银柱又慢慢回到原标定的刻度。
简要回答下列问题:
(1)水银柱推向左管说明____________ ;
(2)硫粉未燃尽时火焰就熄灭了,说明___________________________ ;
(3)根据水银柱最后又回到原先标定的刻度,可得到的结论是____________ ;
(4)根据反应方程式S+O2 SO2和上述结论又可推导出什么(或证明什么)?
SO2和上述结论又可推导出什么(或证明什么)?________ 。

简要回答下列问题:
(1)水银柱推向左管说明
(2)硫粉未燃尽时火焰就熄灭了,说明
(3)根据水银柱最后又回到原先标定的刻度,可得到的结论是
(4)根据反应方程式S+O2
 SO2和上述结论又可推导出什么(或证明什么)?
SO2和上述结论又可推导出什么(或证明什么)?
您最近一年使用:0次
2 . I.用NA表示阿伏加德罗常数的值,按要求填空:
(1)在标准状况下,①6.72LCH4;②3.01×1023个HCl分子;③13.6gH2S;④0.2molNH3。下列关系表达正确的是_______ 。
a.体积②>①>③>④ b.密度②>③>④>①
c.质量②>①>③>④ d.氢原子个数①>③>④>②
(2)8.4gN2与9.6gRx的分子数目之比为3:2,原子数目相同。则:9.6gRx的物质的量为_______ mol。x值为_______ ,R的相对原子质量是_______ 。
II.同温同压下,100mLX2气体与50mLY2气体恰好完全反应,得到100mLZ气体。
(3)Z的化学式为_______ 。
III.
(4)将2.3钠投入足量水中,完全反应。冷却到标准状况,得到_______ L气体。
IV.在容积固定的密闭容器中,活塞可自由移动。在室温下,向A室充入一定量H2、O2的混合气体,向B室充入1mollN2,此时活塞的位置如图所示。

(5)A室混合气体的物质的量为_______ mol。
(6)实验测得A室混合气体的质量为34g,则A室中H2的物质的量为_______ 。
(1)在标准状况下,①6.72LCH4;②3.01×1023个HCl分子;③13.6gH2S;④0.2molNH3。下列关系表达正确的是
a.体积②>①>③>④ b.密度②>③>④>①
c.质量②>①>③>④ d.氢原子个数①>③>④>②
(2)8.4gN2与9.6gRx的分子数目之比为3:2,原子数目相同。则:9.6gRx的物质的量为
II.同温同压下,100mLX2气体与50mLY2气体恰好完全反应,得到100mLZ气体。
(3)Z的化学式为
III.
(4)将2.3钠投入足量水中,完全反应。冷却到标准状况,得到
IV.在容积固定的密闭容器中,活塞可自由移动。在室温下,向A室充入一定量H2、O2的混合气体,向B室充入1mollN2,此时活塞的位置如图所示。

(5)A室混合气体的物质的量为
(6)实验测得A室混合气体的质量为34g,则A室中H2的物质的量为
您最近一年使用:0次
3 . 请回答下列问题:
(1)一定条件下,下列物质可以通过化合反应制得的有___________ (填序号)。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁
(2)同温同压下,等质量的CO气体和CO2气体的体积比为___________ 。
(3)某实验过程中需要用1.0mol/L H2SO4溶液配制0.1mol/L H2SO4溶液475mL,配制过程中需要用到下列仪器中的___________ (填选项),还缺少的玻璃仪器有量筒、玻璃棒、___________ 。
A.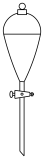 B.
B.  C.
C. 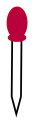 D.
D.
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜。古代铁匠常用红热的铁浸入水中形成烤蓝,体现该原理的化学方程式为___________ 。
(5)工业上将Cl2通入冷的石灰乳中制取漂白粉,写出反应的化学方程式___________ 。
(1)一定条件下,下列物质可以通过化合反应制得的有
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁
(2)同温同压下,等质量的CO气体和CO2气体的体积比为
(3)某实验过程中需要用1.0mol/L H2SO4溶液配制0.1mol/L H2SO4溶液475mL,配制过程中需要用到下列仪器中的
A.
 B.
B.  C.
C. 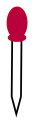 D.
D.
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜。古代铁匠常用红热的铁浸入水中形成烤蓝,体现该原理的化学方程式为
(5)工业上将Cl2通入冷的石灰乳中制取漂白粉,写出反应的化学方程式
您最近一年使用:0次
4 . 实验室欲用NaOH固体配制1.0mol·L-1的NaOH溶液480mL。回答下列问题:
(1)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管和容量瓶。下列关于容量瓶的叙述中正确的是_____ (填字母)。
a.是配制准确浓度溶液的仪器 b.能长期贮存溶液
c.能直接加热 d.使用之前要检查是否漏水
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为_____ g,要完成本实验该同学应称取_____ gNaOH。

(3)在配制过程中,其他操作均正确,下列操作会引起浓度偏高的是_____ (填字母)。
a.没有洗涤烧杯和玻璃棒 b.转移溶液时不慎有少量洒到容量瓶外面
c.容量瓶不干燥,含有少量蒸馏水 d.定容时俯视刻度线
(4)为探究CO2、SO2与NaOH反应的能量变化,某同学用配制的NaOH溶液和绝热容器(与外界没有热交换,忽略气体压缩或膨胀导致的能量变化)进行下列实验。

①关闭弹簧夹K1和K2,从气阀中通入0.1molCO2和0.1molSO2气体,关闭气阀,此时气室I与气室Ⅱ的容积之比为_____ ;室内气体密度之比为_____ 。
②打开弹簧夹K1、K2,用注射器同时注入10mL1mol·L-1NaOH溶液,立即关闭弹簧夹K1、K2,充分反应后,发现气室Ⅱ的容积大于气室I,可以得出的实验结论是_____ 。
(1)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管和容量瓶。下列关于容量瓶的叙述中正确的是
a.是配制准确浓度溶液的仪器 b.能长期贮存溶液
c.能直接加热 d.使用之前要检查是否漏水
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为

(3)在配制过程中,其他操作均正确,下列操作会引起浓度偏高的是
a.没有洗涤烧杯和玻璃棒 b.转移溶液时不慎有少量洒到容量瓶外面
c.容量瓶不干燥,含有少量蒸馏水 d.定容时俯视刻度线
(4)为探究CO2、SO2与NaOH反应的能量变化,某同学用配制的NaOH溶液和绝热容器(与外界没有热交换,忽略气体压缩或膨胀导致的能量变化)进行下列实验。

①关闭弹簧夹K1和K2,从气阀中通入0.1molCO2和0.1molSO2气体,关闭气阀,此时气室I与气室Ⅱ的容积之比为
②打开弹簧夹K1、K2,用注射器同时注入10mL1mol·L-1NaOH溶液,立即关闭弹簧夹K1、K2,充分反应后,发现气室Ⅱ的容积大于气室I,可以得出的实验结论是
您最近一年使用:0次
解题方法
5 . 物质的量在化学计算中占据核心地位。
(1)①标准状况下气体的摩尔体积为___________ 。
②标准状况下6.72L某气体质量13.2g,该物质的摩尔质量为___________ 。
③该气体所含有的分子总个数为___________ 。
④将该气体完全溶于水配成300mL溶液,物质的量浓度为___________ 。
(2)在相同状况下,等质量的SO2与O2的体积比为___________ 。
(3)实验室制Cl2:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
工业制漂白粉:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
现以26.1gMnO2与足量的浓盐酸反应,将生成的Cl2全部制得漂白粉,理论上得到漂白粉的质量为___________ (写出计算过程)。
(1)①标准状况下气体的摩尔体积为
②标准状况下6.72L某气体质量13.2g,该物质的摩尔质量为
③该气体所含有的分子总个数为
④将该气体完全溶于水配成300mL溶液,物质的量浓度为
(2)在相同状况下,等质量的SO2与O2的体积比为
(3)实验室制Cl2:MnO2 + 4HCl(浓)
 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O工业制漂白粉:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
现以26.1gMnO2与足量的浓盐酸反应,将生成的Cl2全部制得漂白粉,理论上得到漂白粉的质量为
您最近一年使用:0次
解题方法
6 . 一氧化氮可用作人造丝的漂白剂及丙烯和二甲醚的安定剂。
(1)工业上在钯或铂催化加热作用下,氨气与氧气制备一氧化氮的反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H。
已知:①

②

③

则△H=_______ kJ/mol(用含a、b、c的代数式表示)。
(2)1073 K时,在容积不变的密闭容器中发生反应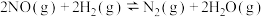 ,测得反应速率与NO、H2浓度的变化如下表。
,测得反应速率与NO、H2浓度的变化如下表。
该反应的速率方程为 ,则m=
,则m=_______ ,n=_______ ,k=_______ (保留两位有效数字) 。
。
(3)T℃时,在2 L恒容密闭容器中充入1 mol NO、1 mol H2,发生反应
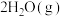 ,起始时体系压强为p MPa,t min时反应达到平衡,此时测得N2的物质的量分数为25%。
,起始时体系压强为p MPa,t min时反应达到平衡,此时测得N2的物质的量分数为25%。
①平衡时,体系压强p=_______ MPa。
②平衡时,c(N2)=_______ 。
③T℃时,该反应的压强平衡常数Kp=_______ MPa-1(用含p的代数式表示,Kp为以分压表示的平衡常数,分压=总压×气体的物质的量分数)。
(1)工业上在钯或铂催化加热作用下,氨气与氧气制备一氧化氮的反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H。
已知:①


②


③


则△H=
(2)1073 K时,在容积不变的密闭容器中发生反应
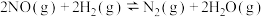 ,测得反应速率与NO、H2浓度的变化如下表。
,测得反应速率与NO、H2浓度的变化如下表。| 实验序号 | 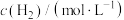 |  |  |
| 1 | 0.0060 | 0.0010 |  |
| 2 | 0.0060 | 0.0020 | 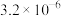 |
| 3 | 0.0030 | 0.0040 |  |
| 4 | 0.0015 | 0.0040 | 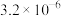 |
该反应的速率方程为
 ,则m=
,则m= 。
。(3)T℃时,在2 L恒容密闭容器中充入1 mol NO、1 mol H2,发生反应

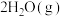 ,起始时体系压强为p MPa,t min时反应达到平衡,此时测得N2的物质的量分数为25%。
,起始时体系压强为p MPa,t min时反应达到平衡,此时测得N2的物质的量分数为25%。①平衡时,体系压强p=
②平衡时,c(N2)=
③T℃时,该反应的压强平衡常数Kp=
您最近一年使用:0次
名校
解题方法
7 . Ⅰ。回答下列问题:
(1)标准状况下,H2、D2、T2的密度之比为_______ ,同温同压下,1LD2和T2气体中所含的中子数之比为_______ 。
(2)现有①BaCl2②Na2O2③KOH④Na2SO4⑤干冰⑥H2SO4六种物质,熔化时不需要破坏化学键的是_______ (填写物质的序号,下同),只含有离子键的物质是_______ 。
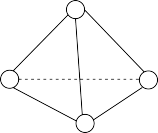
(3)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要_______ (填“吸收”或“放出”)热量_______ kJ。
Ⅱ.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如图的实验:原电池原理判断金属的活泼性。
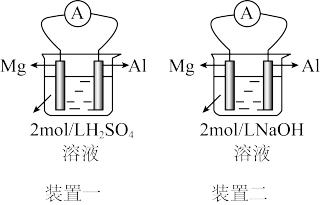
(4)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,若根据他的判断,两个装置中的Al都是_______ 极;实际实验时发现两个装置中的电流表偏转方向不同,以下的有关中判断正确的是_______ 。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
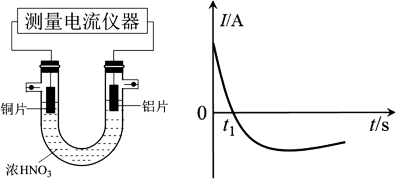
(5)乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是_______ 。
(1)标准状况下,H2、D2、T2的密度之比为
(2)现有①BaCl2②Na2O2③KOH④Na2SO4⑤干冰⑥H2SO4六种物质,熔化时不需要破坏化学键的是
(3)如图所示,N4分子结构与白磷分子相似,呈正四面体结构。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要

Ⅱ.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如图的实验:原电池原理判断金属的活泼性。

(4)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,若根据他的判断,两个装置中的Al都是
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
(5)乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是

您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)10.8 g水与___________ mol硫酸所含的分子数相等,它们所含氧原子数之比是___________ 。
(2)质量相等的CO和CO2中,同温同压下所占的体积比为___________ 。
(3)4.0g某气体X中含有的分子数约为3.01×1022,则气体X的摩尔质量为___________ 。
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 0.1 mol· L-1的稀硫酸。

(4)经计算,配制480mL 0.1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为___________ mL ,应选___________ (填标号)量器。
①5mL量筒②10mL量筒③50mL量筒④100mL量筒
(5)该实验需要使用到的玻璃仪器有:量筒、烧杯、玻璃棒、___________ 。
(6)在配制过程中,下列操作中能使所配溶液的浓度偏高的有___________ (填代号)。
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
(7)若用NaOH固体完全中和480mL 0.1mol· L-1的稀硫酸,需要用托盘天平称量NaOH固体至少___________ g。
(1)10.8 g水与
(2)质量相等的CO和CO2中,同温同压下所占的体积比为
(3)4.0g某气体X中含有的分子数约为3.01×1022,则气体X的摩尔质量为
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 0.1 mol· L-1的稀硫酸。

(4)经计算,配制480mL 0.1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为
①5mL量筒②10mL量筒③50mL量筒④100mL量筒
(5)该实验需要使用到的玻璃仪器有:量筒、烧杯、玻璃棒、
(6)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
(7)若用NaOH固体完全中和480mL 0.1mol· L-1的稀硫酸,需要用托盘天平称量NaOH固体至少
您最近一年使用:0次
9 . 回答下列问题:
(1)在紫外线作用下,氧气可转化为臭氧: ,低空臭氧的浓度过高时对人体有害,因此要尽量避免在阳光强烈照射的中午前后进行户外活动。
,低空臭氧的浓度过高时对人体有害,因此要尽量避免在阳光强烈照射的中午前后进行户外活动。
① 转化为
转化为 属于
属于_______ (填“化学”或“物理”)变化;
②同温同压下,等质量的 和
和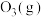 的分子数之比为
的分子数之比为_______ ,密度之比为_______ ;
③1.6g 和
和 的混合气体中含有氧原子的数目为
的混合气体中含有氧原子的数目为_______ (用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(2)某工厂排放的无色废水中可能含有 、
、 、
、 、
、 、
、 中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:
中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:
①废水中一定没有的离子是_______ (填离子符号)。
②向废水中加过量浓氢氧化钠溶液,可能出现的现象是_______ 。
③为确定废水中还可能存在的以上离子,具体的实验方法是将少量废水放入试管中,向其中加入稀硝酸至不再产生气体,然后再_______ 。
(1)在紫外线作用下,氧气可转化为臭氧:
 ,低空臭氧的浓度过高时对人体有害,因此要尽量避免在阳光强烈照射的中午前后进行户外活动。
,低空臭氧的浓度过高时对人体有害,因此要尽量避免在阳光强烈照射的中午前后进行户外活动。①
 转化为
转化为 属于
属于②同温同压下,等质量的
 和
和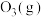 的分子数之比为
的分子数之比为③1.6g
 和
和 的混合气体中含有氧原子的数目为
的混合气体中含有氧原子的数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(2)某工厂排放的无色废水中可能含有
 、
、 、
、 、
、 、
、 中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:
中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:①废水中一定没有的离子是
②向废水中加过量浓氢氧化钠溶液,可能出现的现象是
③为确定废水中还可能存在的以上离子,具体的实验方法是将少量废水放入试管中,向其中加入稀硝酸至不再产生气体,然后再
您最近一年使用:0次
21-22高一上·江苏苏州·阶段练习
名校
10 . 按要求进行计算,直接写出计算结果:
(1)0.5molC2H6O的质量是___________ g,约含___________ 个C2H6O分子,含___________ mol氢原子。
(2)7.1gNa2SO4的物质的量为___________ mol,其中Na+的数目为___________
(3)38.4gSO2在标准状况下的体积为___________ L,等质量的SO2和SO3,物质的量之比为___________ ;氧原子个数之比为___________ 。同温同压下,SO2和SO3的密度之比为___________ 。
(4)现有标准状况下CO2和CO的混合气体为6.72L,其质量为10g,则此混合气体中,CO2和CO的物质的量之比是___________ 。
(5)已知某种由NaCl和MgCl2组成的混合物中,Na+与Mg2+的物质的量之比为1:4,则此混合物中NaCl和MgCl2的物质的量之比是______ 。如果该混合物中含1.8molCl-,那么此混合物中有_____ 个Mg2+离子。
(1)0.5molC2H6O的质量是
(2)7.1gNa2SO4的物质的量为
(3)38.4gSO2在标准状况下的体积为
(4)现有标准状况下CO2和CO的混合气体为6.72L,其质量为10g,则此混合气体中,CO2和CO的物质的量之比是
(5)已知某种由NaCl和MgCl2组成的混合物中,Na+与Mg2+的物质的量之比为1:4,则此混合物中NaCl和MgCl2的物质的量之比是
您最近一年使用:0次



