23-24高三上·广东潮州·期末
1 . H2O2在纸张漂白和废水处理等领域有重要应用。一定条件下用H2和O2合成H2O2的反应过程如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
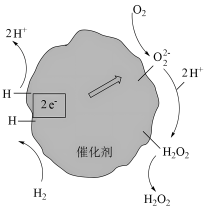

| A.1molH2O2中含2NAσ键,不含π键 |
| B.合成1molH2O2,电子转移数为4NA |
| C.lmol的H2O2含18NA电子 |
| D.标准状况下,4.48LH2O2中含有0.2NAH2O2分子 |
您最近一年使用:0次
23-24高三上·河南驻马店·期末
名校
解题方法
2 . 碱式硫酸镁晶须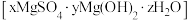 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含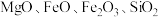 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
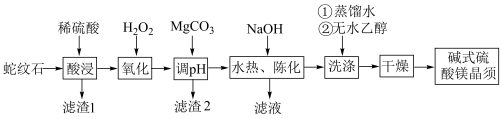
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是_______ 。
(2)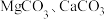 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:_______ 。
(3)洗涤步骤中用无水乙醇洗涤的目的是_______ 。
(4)氧化的目的是_______ (用离子方程式表示),为检验溶液中的离子是否完全被氧化,可使用的试剂为_______ (填化学式)。
(5)将碱式硫酸镁晶须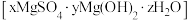 进行热重分析测定其化学式,
进行热重分析测定其化学式, 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为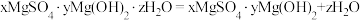 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
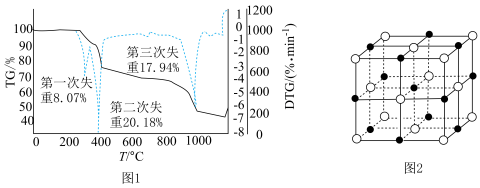
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为_______ ;第二次失重发生反应的化学方程式为_______ 。
②图2中的晶胞参数为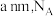 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为_______ ,该晶体的密度为_______  。
。
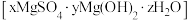 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含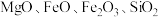 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是
(2)
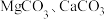 在高温下均易分解,但
在高温下均易分解,但 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:(3)洗涤步骤中用无水乙醇洗涤的目的是
(4)氧化的目的是
(5)将碱式硫酸镁晶须
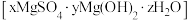 进行热重分析测定其化学式,
进行热重分析测定其化学式, 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为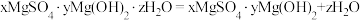 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为
②图2中的晶胞参数为
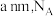 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为 。
。
您最近一年使用:0次
2024-01-22更新
|
261次组卷
|
4卷引用:T28-工业流程题
23-24高三上·河南南阳·阶段练习
3 . 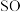 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开 1和
1和 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
①装置C的溶液为_______ (填标号)。装置D可观察到的实验现象为_______ 。
a.品红 b.NaOH c.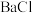 2 d.
2 d. e.浓硫酸
e.浓硫酸
②写出硫酸亚铁高温分解的化学方程式_______ 。
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性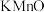 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
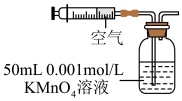
①二氧化硫和酸性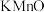 4溶液反应的离子方程式为
4溶液反应的离子方程式为_______ 。
②该空气中二氧化硫的体积分数为_______ (用含Ⅴ的代数式表示)。
(3)某化工厂用如图所示工艺流程除去燃煤产生的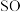 2。
2。

①过程I发生的反应中,氧化剂与还原剂的物质的量之比为_______ 。
②过程Ⅱ发生反应的化学方程式为_______ 。
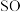 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开
 1和
1和 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
①装置C的溶液为
a.品红 b.NaOH c.
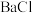 2 d.
2 d. e.浓硫酸
e.浓硫酸②写出硫酸亚铁高温分解的化学方程式
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性
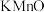 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
①二氧化硫和酸性
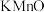 4溶液反应的离子方程式为
4溶液反应的离子方程式为②该空气中二氧化硫的体积分数为
(3)某化工厂用如图所示工艺流程除去燃煤产生的
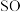 2。
2。
①过程I发生的反应中,氧化剂与还原剂的物质的量之比为
②过程Ⅱ发生反应的化学方程式为
您最近一年使用:0次
23-24高三上·河南·期中
名校
4 . 设NA为阿伏加德罗常数的值,对有关反应:2Na2O2+2SO3=2Na2SO4+O2的说法中,正确的是
| A.当有4mol电子转移时,生成的氧分子数目为2NA |
| B.标准状况下,2.24LSO3中含有氧原子的数目为0.3NA |
| C.14.2gNa2SO4中含有Na2SO4分子的数目为0.1NA |
| D.0.1molNa2O2中离子总数为0.4NA |
您最近一年使用:0次
23-24高三上·河南·阶段练习
5 . 已知: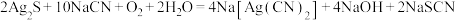 。若
。若 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
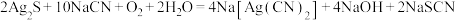 。若
。若 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.10 g质量分数为28%的NaOH溶液中含氢原子数目为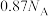 |
B. NaCN溶液中含阴离子总数大于 NaCN溶液中含阴离子总数大于 |
C.当生成1 mol NaSCN时转移的电子数目为 |
D.当有11.2 L  参与反应时,消耗的水分子数目为 参与反应时,消耗的水分子数目为 |
您最近一年使用:0次
2023-10-11更新
|
370次组卷
|
5卷引用:选择题1-5
23-24高三上·河北邢台·阶段练习
名校
解题方法
6 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.11.2L  含有的电子总数为5 含有的电子总数为5 |
B.足量 与含4mol HCl的浓盐酸充分反应,转移的电子数为2 与含4mol HCl的浓盐酸充分反应,转移的电子数为2 |
C.0.1mol  和0.1mol I2于密闭容器中充分反应后,HI分子总数为0.2 和0.1mol I2于密闭容器中充分反应后,HI分子总数为0.2 |
D.0.1mol肼( )中含有的孤电子对数为0.2 )中含有的孤电子对数为0.2 |
您最近一年使用:0次
2023-09-27更新
|
117次组卷
|
6卷引用:选择题1-5
23-24高三上·河南·阶段练习
名校
解题方法
7 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.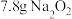 和 和 的混合物中所含的阴离子总数为 的混合物中所含的阴离子总数为 |
B.标准状况下,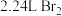 中含有的原子数目为 中含有的原子数目为 |
C.标准状况下, 溶于水,溶液中 溶于水,溶液中 、 、 和 和 的微粒数之和为 的微粒数之和为 |
D. 与足量酸性 与足量酸性 溶液充分反应,转移电子数为 溶液充分反应,转移电子数为 |
您最近一年使用:0次
2023-09-23更新
|
248次组卷
|
3卷引用:选择题1-5
23-24高三上·河南·阶段练习
8 . 用 表示阿伏加德罗常数的值,下列说法中正确的是
表示阿伏加德罗常数的值,下列说法中正确的是
 表示阿伏加德罗常数的值,下列说法中正确的是
表示阿伏加德罗常数的值,下列说法中正确的是A.标准状况下,22.4LCO中 键数目为 键数目为 |
B.1L HF溶液中, HF溶液中, 数目为 数目为 |
C.168gFe与水蒸气完全反应时转移电子数目为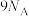 |
D.0.1mol 与足量水反应生成的1-丙醇的数目为 与足量水反应生成的1-丙醇的数目为 |
您最近一年使用:0次
22-23高一下·北京海淀·开学考试
名校
解题方法
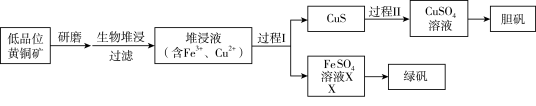
9 . 工业上,处理低品位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4∙7H2O)和胆矾(CuSO4∙5H2O)。相关流程如下图。
已知:①溶液中的c(H+)越大,pH越小,酸性越强。
②生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
③溶液中pH很小时,金属通常以离子形式存在,随着pH增大,有些离子会形成氢氧化物沉淀(即使pH<7也可沉淀),不同离子形成沉淀时的pH如下表所示。
(1)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段是在T。f细菌作用下,将黄铜矿溶解,第二阶段为Fe2+继续被氧化转变成Fe3+。
①补全第一阶段反应的离子方程式(反应物已配平):_______ 。CuFeS2+4H++O2 =_______。
=_______。
②写出第二阶段反应的离子方程式:_______ 。
(2)结合已知推断:生物堆浸过程中,应控制溶液的pH在_______ 范围内。
(3)已知:CuS是一种难溶于水的黑色固体。过程II中,用H2O2和稀硫酸处理后,CuS完全溶解 ,用离子方程式表示H2O2的作用是_______ 。
(4)绿矾的纯度可通过其与KMnO4反应测定。取mg绿矾晶体,加适量稀硫酸溶解,与物质的量浓度为cmol/L的KMnO4溶液恰好反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为_______ 。(已知:FeSO4·7H2O摩尔质量为278g/mol)

已知:①溶液中的c(H+)越大,pH越小,酸性越强。
②生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
③溶液中pH很小时,金属通常以离子形式存在,随着pH增大,有些离子会形成氢氧化物沉淀(即使pH<7也可沉淀),不同离子形成沉淀时的pH如下表所示。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
①补全第一阶段反应的离子方程式(反应物已配平):
 =_______。
=_______。②写出第二阶段反应的离子方程式:
(2)结合已知推断:生物堆浸过程中,应控制溶液的pH在
(3)已知:CuS是一种难溶于水的黑色固体。过程II中,用H2O2和稀硫酸处理后,CuS
(4)绿矾的纯度可通过其与KMnO4反应测定。取mg绿矾晶体,加适量稀硫酸溶解,与物质的量浓度为cmol/L的KMnO4溶液恰好反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为
您最近一年使用:0次
21-22高三上·湖北宜昌·阶段练习
名校
解题方法
10 . 用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.1 mol甲基(—CH3)所含的电子数为10NA |
| B.常温常压下,1 mol分子式为C2H6O的有机物中,含有C—O键的数目为NA |
C.14 g由乙烯和环丙烷( )组成的混合气体中,含有的原子总数为3NA )组成的混合气体中,含有的原子总数为3NA |
| D.100 g 46%乙醇溶液中含有的H—O键的数目为NA |
您最近一年使用:0次
2022-12-20更新
|
861次组卷
|
4卷引用:河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(1-8)
(已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(1-8)(已下线)题型4 阿伏伽德罗常数的综合应用-高考必备50个题型湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题湖北省襄阳市第一中学2022-2023学年高二上学期1月期末考试化学试题



