22-23高三上·安徽·期末
1 .  在催化剂条件下可被
在催化剂条件下可被 还原为无害物质,反应为:
还原为无害物质,反应为:
 。下列说法正确的是
。下列说法正确的是
 在催化剂条件下可被
在催化剂条件下可被 还原为无害物质,反应为:
还原为无害物质,反应为:
 。下列说法正确的是
。下列说法正确的是A.上述反应 |
B.上述反应平衡常数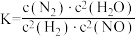 |
C.上述反应中生成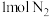 ,转移电子的数目为 ,转移电子的数目为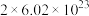 |
D.上述反应中,充入水蒸气增大压强可以提高 平衡转化率 平衡转化率 |
您最近一年使用:0次
2023-01-09更新
|
652次组卷
|
6卷引用:选择题6-10
(已下线)选择题6-10(已下线)化学-2023年高考押题预测卷03(江苏卷)(含考试版、全解全析、参考答案、答题卡)(已下线)第三章 单元测试卷考点巩固卷08 化学反应速率与化学平衡(3大考点45题)-2024年高考化学一轮复习考点通关卷(新高考通用)安徽省皖东县中联盟2022-2023学年高三上学期期末联考化学试题河北省石家庄市部分学校2022-2023学年高三下学期开学考试化学试题
22-23高三上·福建·阶段练习
名校
解题方法
2 . 向 溶液中逐滴加入
溶液中逐滴加入 溶液至过量,观察到产生白色沉淀
溶液至过量,观察到产生白色沉淀 ,溶液变为棕色。再向反应后的混合物中不断通入
,溶液变为棕色。再向反应后的混合物中不断通入 气体,溶液逐渐变成无色。下列分析正确的是
气体,溶液逐渐变成无色。下列分析正确的是
 溶液中逐滴加入
溶液中逐滴加入 溶液至过量,观察到产生白色沉淀
溶液至过量,观察到产生白色沉淀 ,溶液变为棕色。再向反应后的混合物中不断通入
,溶液变为棕色。再向反应后的混合物中不断通入 气体,溶液逐渐变成无色。下列分析正确的是
气体,溶液逐渐变成无色。下列分析正确的是A.滴加 溶液时,转移 溶液时,转移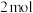 电子时生成 电子时生成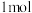 白色沉淀 白色沉淀 |
B.通入 后溶液逐渐变成无色,体现了 后溶液逐渐变成无色,体现了 的漂白性 的漂白性 |
C.通入 时, 时, 与 与 反应, 反应, 作还原剂 作还原剂 |
D.上述实验条件下,物质的氧化性: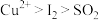 |
您最近一年使用:0次
2022-12-02更新
|
224次组卷
|
5卷引用:选择题6-10
22-23高三上·山东德州·期中
3 . 捕集 的技术对解决全球温室效应意义重大。回答下列问题。
的技术对解决全球温室效应意义重大。回答下列问题。
(1)国际空间站处理 的一个重要方法是将
的一个重要方法是将 还原,所涉及的反应方程式为:
还原,所涉及的反应方程式为:
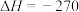
 几种化学键的键能如表所示:
几种化学键的键能如表所示:
则
______ 。
(2)将 还原为
还原为 ,是实现
,是实现 资源化利用的有效途径之一。装置如图所示:
资源化利用的有效途径之一。装置如图所示:
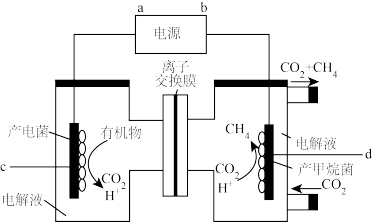
① 的移动方向为
的移动方向为______ (填“自左至右”或“自右至左”);d电极的电极反应式为____________ 。
②若电源为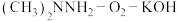 清洁燃料电池,当消耗0.1mol燃料
清洁燃料电池,当消耗0.1mol燃料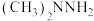 时,离子交换膜中通过
时,离子交换膜中通过______ mol ,该清洁燃料电池中的正极反应式为
,该清洁燃料电池中的正极反应式为____________ 。
(3)CaO可在较高温度下捕集 。
。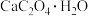 热分解可制备CaO,
热分解可制备CaO,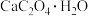 加热升温过程中固体的质量变化如图。
加热升温过程中固体的质量变化如图。
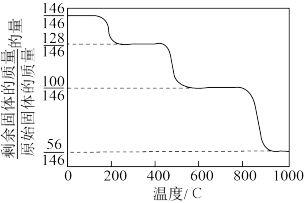
则400~600℃时分解得到的气体产物是______ (填化学式),写出800∼1000℃范围内分解反应的化学方程式:__________________________________________ 。
 的技术对解决全球温室效应意义重大。回答下列问题。
的技术对解决全球温室效应意义重大。回答下列问题。(1)国际空间站处理
 的一个重要方法是将
的一个重要方法是将 还原,所涉及的反应方程式为:
还原,所涉及的反应方程式为:
 几种化学键的键能如表所示:
几种化学键的键能如表所示:化学键 |
|
|
|
|
键能/kJ⋅mol | 413 | 436 | a | 745 |

(2)将
 还原为
还原为 ,是实现
,是实现 资源化利用的有效途径之一。装置如图所示:
资源化利用的有效途径之一。装置如图所示:
①
 的移动方向为
的移动方向为②若电源为
 清洁燃料电池,当消耗0.1mol燃料
清洁燃料电池,当消耗0.1mol燃料 时,离子交换膜中通过
时,离子交换膜中通过 ,该清洁燃料电池中的正极反应式为
,该清洁燃料电池中的正极反应式为(3)CaO可在较高温度下捕集
 。
。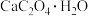 热分解可制备CaO,
热分解可制备CaO,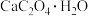 加热升温过程中固体的质量变化如图。
加热升温过程中固体的质量变化如图。
则400~600℃时分解得到的气体产物是
您最近一年使用:0次
2022·江苏南京·模拟预测
名校
解题方法
4 . 四水醋酸锰[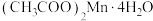 ]用于染色催化剂和分析试剂等。
]用于染色催化剂和分析试剂等。
(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得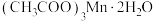 。将
。将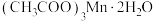 在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
①第一阶段释放出2种等物质的量的物质,它们的分子式分别为_______ 。
②剩余物B的化学式为_______ 。
(2)用四水醋酸锰和乙酰氯(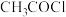 )为原料制备无水二氯化锰流程如下:
)为原料制备无水二氯化锰流程如下:
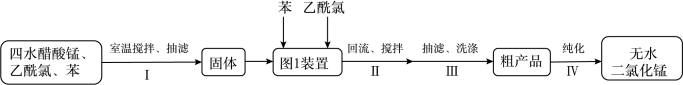
已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应: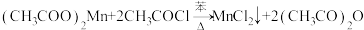
c.乙酰氯遇水发生反应: 。
。
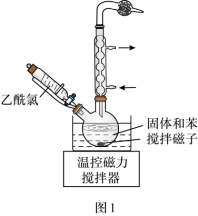
请回答:
①步骤Ⅰ所获固体主要成分是_______ (用化学式表示)。
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是_______ 。
③测定无水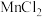 的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量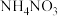 ,使
,使 氧化为
氧化为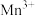 。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[
。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[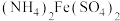 ]滴定
]滴定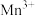 ,滴定过程中发生的反应为:
,滴定过程中发生的反应为: ,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是
,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是_______ 。样品中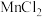 的质量分数多少(写出计算过程)。
的质量分数多少(写出计算过程)。_______
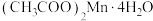 ]用于染色催化剂和分析试剂等。
]用于染色催化剂和分析试剂等。(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得
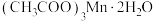 。将
。将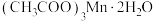 在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。| 阶段 | 热效应 | 剩余物 | 失重 |
| Ⅰ | 吸热 | A | 29.1% |
| Ⅱ | 放热 | B | 70.5% |
②剩余物B的化学式为
(2)用四水醋酸锰和乙酰氯(
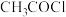 )为原料制备无水二氯化锰流程如下:
)为原料制备无水二氯化锰流程如下:
已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应:
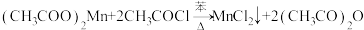
c.乙酰氯遇水发生反应:
 。
。
请回答:
①步骤Ⅰ所获固体主要成分是
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是
③测定无水
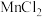 的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量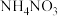 ,使
,使 氧化为
氧化为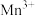 。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[
。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[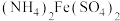 ]滴定
]滴定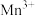 ,滴定过程中发生的反应为:
,滴定过程中发生的反应为: ,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是
,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是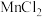 的质量分数多少(写出计算过程)。
的质量分数多少(写出计算过程)。
您最近一年使用:0次
5 . 计算后填空:
(1)在标准状况下,448 mL某气体的质量为0.64 g,这种气体的相对分子质量为______ 。
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为______ 。
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为_______ 。
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为_____ mol·L-1。
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为______ 、______ 。
(6)如图所示, 分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为
分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为________ 。
(1)在标准状况下,448 mL某气体的质量为0.64 g,这种气体的相对分子质量为
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为
(3)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为
(5)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为
(6)如图所示,
 分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为
分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为
您最近一年使用:0次
2020-09-24更新
|
149次组卷
|
6卷引用:苏教版2017届高三单元精练检测一化学试题
苏教版2017届高三单元精练检测一化学试题人教版2017届高三单元精练检测一化学试题(已下线)2019年7月7日 《每日一题》 2020年高考一轮复习-每周一测2016-2017学年河南省郸城中学高一上第一次考试化学卷安徽省霍邱县第二中学2021届高三上学期开学考试化学试题河南省温县第一高级中学2021-2022学年高三上学期12月月考化学试题
2020·江苏盐城·三模
6 . ClO2广泛用于水处理、纸浆漂白等。
(1)制备ClO2原料有NaClO2等,产生的ClO2(g)用蒸馏水吸收得到吸收液A。
①ClO2中氯元素的化合价为___ 。
②NaClO2与盐酸在微热条件下生成ClO2气体(及少量副产物Cl2),写出其反应生成ClO2、NaCl和水的化学方程式:___ 。
(2)碘量法测定ClO2吸收液A中ClO2和Cl2的浓度的主要实验步骤如下:
步骤1.向锥形瓶中加入50mL蒸馏水、25mL100g·L-1KI溶液(足量),再向其中加入5.00mLClO2吸收液(发生反应:2ClO2+2KI=2KClO2+I2,Cl2+2KI=2KCl+I2)。
步骤2.用0.1000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉溶液,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液6.00mL。
步骤3.向步骤2的溶液中加入5mL2mol·L-1硫酸溶液酸化,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O。
步骤4.重复步骤2操作,第二次滴定又消耗0.1000mol·L-1Na2S2O3溶液20.00mL。
根据上述数据,计算ClO2吸收液A中ClO2和Cl2的浓度___ (单位g·L-1,写出计算过程)。
(1)制备ClO2原料有NaClO2等,产生的ClO2(g)用蒸馏水吸收得到吸收液A。
①ClO2中氯元素的化合价为
②NaClO2与盐酸在微热条件下生成ClO2气体(及少量副产物Cl2),写出其反应生成ClO2、NaCl和水的化学方程式:
(2)碘量法测定ClO2吸收液A中ClO2和Cl2的浓度的主要实验步骤如下:
步骤1.向锥形瓶中加入50mL蒸馏水、25mL100g·L-1KI溶液(足量),再向其中加入5.00mLClO2吸收液(发生反应:2ClO2+2KI=2KClO2+I2,Cl2+2KI=2KCl+I2)。
步骤2.用0.1000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉溶液,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液6.00mL。
步骤3.向步骤2的溶液中加入5mL2mol·L-1硫酸溶液酸化,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O。
步骤4.重复步骤2操作,第二次滴定又消耗0.1000mol·L-1Na2S2O3溶液20.00mL。
根据上述数据,计算ClO2吸收液A中ClO2和Cl2的浓度
您最近一年使用:0次
名校
解题方法
7 . 三聚氰胺又名蛋白精[分子式: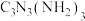 ,相对分子质量:126]是一种低毒性化工产品.婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是( )
,相对分子质量:126]是一种低毒性化工产品.婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是( )
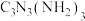 ,相对分子质量:126]是一种低毒性化工产品.婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是( )
,相对分子质量:126]是一种低毒性化工产品.婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是( )A. 三聚氰胺含氮原子数目为 三聚氰胺含氮原子数目为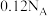 | B.三聚氰胺含氮量约为10% |
C.标准状况下 的三聚氰胺的体积为 的三聚氰胺的体积为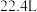 | D.三聚氰胺的摩尔质量为126 |
您最近一年使用:0次
2020-04-02更新
|
358次组卷
|
13卷引用:苏教版2017届高三单元精练检测一化学试题
苏教版2017届高三单元精练检测一化学试题人教版2017届高三单元精练检测一化学试题2014-2015山东省泰安第一中学高二下学期期中考试化学试卷2015-2016学年广东汕头金山中学高一10月月考化学试卷江西省南昌市第二中学2017-2018学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2017-2018学年高二6月月考化学试题天津市南开中学2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】2019 安义中学、南昌十九中 高一上第一次月考(已下线)【南昌新东方】江西省九江市第一中学2018-2019学年高一上学期第一次月考化学试题广西壮族自治区贺州市中学2020-2021学年高二上学期第二次月考化学试题河北省石家庄市第一中学东校区2022届高三上学期教学质量检测(一)化学试题宁夏长庆高级中学 2021-2022学年高三上学期第一次月考化学试题内蒙古包头市第四中学2021-2022学年高一上学期期中考试化学试题
2019·江苏·高考真题
8 . CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
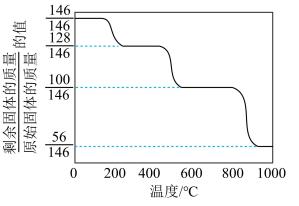
①写出400~600 ℃范围内分解反应的化学方程式:________ 。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________ 。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________ 。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
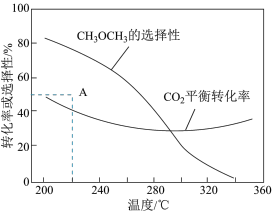
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
CH3OCH3的选择性=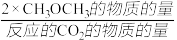 ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________ 。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________ 。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
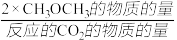 ×100%
×100%①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
您最近一年使用:0次
2019-06-10更新
|
6269次组卷
|
7卷引用:原理综合题
(已下线)原理综合题2019年江苏省高考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习北京市朝阳区第八十中学2020届高三模拟化学试题鲁科版(2019)选择性必修1 模块复习备考攻略人教版(2019)高二选择性必修第一册 模块复习备考攻略湖北省石首一中2020-2021学年高三上学期11月月考化学试题
2013·全国·高考真题
真题
名校
9 . NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A.1.0L1.0mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| C.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA |
| D.1 mol的羟基与1 moL的氢氧根离子所含电子数均为9 NA |
您最近一年使用:0次
2019-01-30更新
|
4496次组卷
|
23卷引用:2014届高考化学二轮复习江苏专用 第2讲化学常用计量练习卷
(已下线)2014届高考化学二轮复习江苏专用 第2讲化学常用计量练习卷2018版化学(苏教版)高考总复习专题一对接高考精练--物质的量 气体摩尔体积(已下线)2014届高考化学二轮复习四川配套训练 第2讲化学常用计量练习卷(已下线)2014高考名师推荐化学NA与粒子人教版必修一化学第一章第二节物质的量浓度相关计算及配制一定浓度的溶液专项训练(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第1讲 物质的量、气体摩尔体积【教学案】【懂做原理题】2020届高三化学选修4二轮专题练——弱电解质的电离 【精编24题】(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷)(已下线)2014届湖北省武汉市部分学校新高三起点调研化学试卷(已下线)2014届河南省顶级名校高三定位测试化学试卷2014-2015河南省陕州中学高二下学期第二次精英对抗赛化学试卷2017届甘肃省兰州一中高三上学期期中化学试卷河南省林州市第一中学2018届高三7月调研考试化学试题江西省上高县第二中学2018届高三第一次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题苏教版必修1高考题单元试卷:专题1 化学家眼中的物质世界山西省太原市第二十一中学2020届高三上学期期中考试化学试题(已下线)考点02 化学常用计量-2020年【衔接教材·暑假作业】新高三一轮复习化学黑龙江省哈尔滨市黑龙江省实验中学2021届高三上学期8月份阶段测试化学试题广东省佛山市第一中学2021-2022学年高三上学期12月模拟考试化学试题陕西省汉中市龙岗学校2022-2023学年高三上学期第一次质量检测化学试题福建省福清西山学校2023-2024学年高三上学期12月月考化学试题
真题
名校
10 . 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧: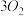


(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为______ g/mol(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为_____________ L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为__________________ 。
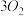


(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为
您最近一年使用:0次
2019-01-30更新
|
1430次组卷
|
16卷引用:2018版化学(苏教版)高考总复习专题一课时跟踪训练:物质的量 气体摩尔体积
2018版化学(苏教版)高考总复习专题一课时跟踪训练:物质的量 气体摩尔体积(已下线)2014年高考化学一轮复习课后规范训练1-2练习卷(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第1讲 物质的量、气体摩尔体积【押题专练】(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第1讲 物质的量 气体摩尔体积( 题型专练)2009年普通高等学校招生统一考试化学试题(上海卷)2009高考真题汇编—氧族元素,环境保护2009高考真题汇编-化学计算(已下线)2011-2012学年武汉二中高一上学期期中考试化学试卷(已下线)2011-2012学年甘肃省天水一中高二第二学段测试化学试卷(已下线)2013-2014学年湖北省武汉二中高一上学期期中考试化学试卷(已下线)2013-2014学年河南省内黄一中高一上学期第一次月考化学试卷2015-2016学年天津市蓟县高一上学期期中化学试卷吉林省白城市第一中学2018-2019学年高二6月月考化学试题内蒙古赤峰二中人教版高中化学必修1练习:化学计量及其应用(3)(已下线)上海虹口区2011届高三一模化学试题








