1 .  代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是
 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是A.18g 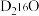 含中子的数目为10 含中子的数目为10 |
B.1mol  中含π键的数目为2 中含π键的数目为2 |
C.0.1  酸性溶液中含 酸性溶液中含 的数目为0.1 的数目为0.1 |
D.同温同压下4mL Ne与4mL  所含原子数目均为4 所含原子数目均为4 |
您最近一年使用:0次
9-10高一下·上海·期中
名校
2 . 如图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶质的物质的量浓度为(不考虑瓶内溶液向烧杯中扩散)

| A.①>② | B.①<② | C.①=② | D.不能确定 |
您最近一年使用:0次
2020-06-19更新
|
1249次组卷
|
52卷引用:2012-2013学年陕西省汉中市中学高三上学期模拟考试化学试卷
(已下线)2012-2013学年陕西省汉中市中学高三上学期模拟考试化学试卷(已下线)2013届安徽省阜阳一中高三上学期第二次模化学试卷(已下线)2010年上海市控江中学高一第二学期期中考试化学试卷(已下线)2011-2012学年安徽省六安三中高一下学期期末考试化学A卷(已下线)2012-2013学年天津市天津一中高一上学期期末考试化学试卷(已下线)2014年高考化学一轮复习课后规范训练4-4练习卷(已下线)2013-2014学年吉林省实验中学高一教学评估(一)化学试卷(已下线)2013-2014黑龙江省双鸭山一中高三上学期期中化学试卷(已下线)2014届江西省南昌一中、南昌十中高三上学期联考化学试卷2014-2015吉林省吉林市一中高一上学期期末化学试卷2014-2015山西省原平市一中高一上学期期末考试化学试卷2014-2015河北省成安县一中高一下学期第一次月考化学试卷2016届甘肃省天水市第一中学高三上学期期中测试化学试卷2015-2016学年安徽省铜陵一中高一下期中化学试卷2015-2016学年云南省玉溪一中高一下期中化学试卷2015-2016学年湖北省沙市中学等校高一5月联考化学试卷2017届河北省定州中学高三上第一次月考化学试卷2016-2017学年河北省冀州中学高一3月月考化学试卷黑龙江省鹤岗第一中学2016-2017学年高一下学期期中考试化学试卷福建省华安中学2017-2018学年高一期末考试化学试题河南省郑州市第一中学2017-2018学年高一下学期入学考试化学试题安徽省师范大学附属中学2017-2018学年高一下学期期中考试化学试题2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】江西省奉新县第一中学2019届高三上学期第二次月考化学试题福建省三明市尤溪县第一中学2018-2019学年高一第二学期入学考试化学试题河南省周口扶沟县高级中学2018-2019学年高一下学期期中考试化学试题福建省龙海市程溪中学2018-2019学年高一下学期期中考试化学试题上海市金山中学2017-2018学年高一下学期期中考试化学试题2020届高三化学二轮冲刺新题专练——氨气性质和应用 (提升练)四川省南充市阆中中学2020届高三化学选择题专项训练(15)黑龙江省哈尔滨师范大学附属中学2019—2020学年高一下学期第二次月考化学试题江西省宜春市宜丰县宜丰中学2019-2020学年高一下学期第一次月考化学试题黑龙江省大庆市肇州县第二中学2019-2020学年高一下学期期末考试化学试题(已下线)第6单元 常见的非金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷山西省晋中市现代双语学校2020-2021学年高一下学期第一次月考化学试题吉林省“BEST合作体”2020-2021学年高一下学期期中化学试题天津市河北区2020-2021学年高一下学期期末考试化学试题辽宁省朝阳市建平县实验中学2020-2021学年度高一下学期期末考试化学试题浙江省诸暨市第二高级中学2020-2021学年高一下学期期中考试化学试题 河南省安阳市殷都区第一高级中学2021-2022学年高一下学期3月月考化学试题河北省定州市2021-2022学年高一下学期期中考试化学试题甘肃省武威第七中学2022-2023学年高三上学期第一次质量检测化学试题福建省福州第一中学2022-2023学年高一下学期4月期中考试化学试题陕西省西安市第一中学2022-2023学年高一下学期5月月考化学试题甘肃省平凉市2022-2023学年高三上学期11月期中化学试题微专题(七) 喷泉实验有关浓度的计算海南省海口市第一中学2023-2024学年高三上学期期末考试化学试题(非重点班)甘肃省兰州第一中学2023-2024学年高一下学期3月月考化学试题天津市第十四中学2023-2024学年高一下学期期中考试化学试题(已下线)专题01 硫、氮及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)重难点02 常见气体的制备、性质、检验-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
名校
3 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.28g乙烯和丙烯的混合气体中含有的碳原子数为2 |
B.1.8g重水 中所含质子数为 中所含质子数为 |
C.电解粗铜精炼铜,通过电路的电子数为 时,阳极有32g Cu转化为 时,阳极有32g Cu转化为 |
D.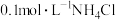 溶液中, 溶液中, 、 、 数目之和为0.1 数目之和为0.1 |
您最近一年使用:0次
2022-11-04更新
|
532次组卷
|
8卷引用:湖南省常德市第一中学2023届高三模拟预测化学试题
名校
4 . 设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.6g SiO2晶体中含有的硅氧键数目为0.2NA |
| B.1L 0.1mol/ LNa2S溶液中含阴离子数目大于0.1NA |
C.lmol/L的NH4Br溶液中通入适量氨气呈中性,此时溶液中NH 的数目为NA 的数目为NA |
| D.60g分子式为C3H8O的有机物中含有C-H键数目为7NA |
您最近一年使用:0次
2021-05-02更新
|
659次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021届高三下学期第二次模拟考试理科综合化学试题
5 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.浓度均为 的 的 和 和 两种溶液中所含 两种溶液中所含 的数目之比为 的数目之比为 |
B.标准状况下, 的甲醛分子中含有的 的甲醛分子中含有的 键数目为 键数目为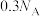 |
C.标准状况下, 氟化氢中含有的分子数目为 氟化氢中含有的分子数目为 |
D. 超重水( 超重水(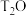 )分子中含有的中子数目为 )分子中含有的中子数目为 |
您最近一年使用:0次
6 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,2.24LSO3中电子的数目为4NA |
B.NaHCO3溶液中Na+和HCO 个数比为1∶1 个数比为1∶1 |
| C.28gC2H4和C3H6的混合气体中含有的C原子数为2NA |
| D.pH=2的H2SO4溶液中H+数目为0.01NA |
您最近一年使用:0次
7 . 某兴趣小组通过下列实验探究 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
(1)探究 与
与 的氧化性强弱
的氧化性强弱
【实验 】将
】将 溶液和
溶液和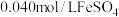 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
_____  (填“>”“<”)。
(填“>”“<”)。
(2)验证反应 是可逆反应
是可逆反应
【实验Ⅱ】
①取实验 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。
②根据实验数据,证明该反应为可逆反应,不需要完成表格中编号_____ 的实验。
(3)测定反应 的平衡常数
的平衡常数
测定方案:通过氧化还原滴定法可测定平衡时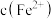 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和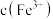 ,进而求算出平衡常数
,进而求算出平衡常数 。
。
【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取 上层清液,用
上层清液,用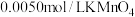 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为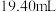 。
。
①用于盛装 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为_____ 。
②平衡时
_____  ,平衡常数
,平衡常数
_____ 。
③若取实验 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值_____ 。
A.偏大 B.偏小 C.无影响 D.无法判断
 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。(1)探究
 与
与 的氧化性强弱
的氧化性强弱【实验
 】将
】将 溶液和
溶液和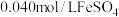 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
 (填“>”“<”)。
(填“>”“<”)。(2)验证反应
 是可逆反应
是可逆反应【实验Ⅱ】
①取实验
 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。| 实验编号 | 操作及现象 | 结论 |
| 1 | 取上层黄色清液,滴加 | 存在 |
| 2 | 取少量灰黑色沉淀,滴加浓硝酸,沉淀溶解,出现红棕色气体 | 存在 |
| 3 | 操作及现象是: | 存在 |
| 4 | 取上层清液,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(3)测定反应
 的平衡常数
的平衡常数测定方案:通过氧化还原滴定法可测定平衡时
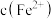 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和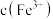 ,进而求算出平衡常数
,进而求算出平衡常数 。
。【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取
 上层清液,用
上层清液,用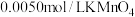 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为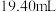 。
。①用于盛装
 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为②平衡时

 ,平衡常数
,平衡常数
③若取实验
 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值A.偏大 B.偏小 C.无影响 D.无法判断
您最近一年使用:0次
8 . 为了探究市售Fe3O4能否与常见的酸(盐酸、稀硫酸)发生反应,实验小组做了以下工作。
Ⅰ.Fe3O4的制备
(1)将可溶性亚铁盐和铁盐按一定配比混合后,加入NaOH溶液,在一定条件下反应可制行Fe3O4,反应的离子方程式为_______ 。
Ⅱ.Fe3O4与酸反应的热力学论证
(2)理论上完全溶解1.16gFe3O4至少需要3 mol/LH2SO4溶液的体积约为_______ mL(保留1位小数)。
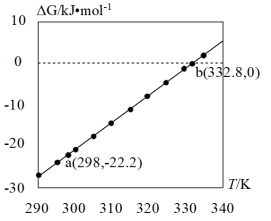
(3)查阅文献:吉布斯自由能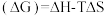 ,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是_______ 。
Ⅲ.Fe3O4与酸反应的实验研究
用10 mL3 mol/LH2SO4溶液浸泡1.0 g Fe3O4粉末,5分钟后各取2 mL澄清浸泡液,按编号i进行实验。(所用 、KSCN溶液均为0.1 mol/L,Fe2+遇
、KSCN溶液均为0.1 mol/L,Fe2+遇 溶液生成蓝色沉淀。)
溶液生成蓝色沉淀。)
(4)实验ⅱ的作用是_______ 。
(5)实验ⅰ中滴加K3[Fe(CN)6]溶液无蓝色沉淀生成,其可能原因是Fe2+的浓度太小,为了验证这一推断,可改进的方法是_______ 。
(6)实验ⅲ:用10 mL6 mol/L盐酸代替H2SO4浸泡样品后,重复实验ⅰ,发现试管①有蓝色沉淀,试管②溶液显红色,说明Cl-有利于Fe3O4与H+反应,为了验证这一推测,可在用H2SO4溶液浸泡时加入_______ ,然后重复实验i。
(7)实验ⅳ:用20 mL6 mol/L盐酸浸泡1.0 g天然磁铁矿粉末,20 min后浸泡液几乎无色,重复实验i,发现试管①、②均无明显现象,与实验iii现象不同的可能原因是_______ 。
Ⅰ.Fe3O4的制备
(1)将可溶性亚铁盐和铁盐按一定配比混合后,加入NaOH溶液,在一定条件下反应可制行Fe3O4,反应的离子方程式为
Ⅱ.Fe3O4与酸反应的热力学论证
(2)理论上完全溶解1.16gFe3O4至少需要3 mol/LH2SO4溶液的体积约为
(3)查阅文献:吉布斯自由能
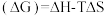 ,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
,在100 kPa下,Fe3O4与酸反应的△G与温度T的关系如图所示。Fe3O4与酸自发反应的温度条件是
Ⅲ.Fe3O4与酸反应的实验研究
用10 mL3 mol/LH2SO4溶液浸泡1.0 g Fe3O4粉末,5分钟后各取2 mL澄清浸泡液,按编号i进行实验。(所用
 、KSCN溶液均为0.1 mol/L,Fe2+遇
、KSCN溶液均为0.1 mol/L,Fe2+遇 溶液生成蓝色沉淀。)
溶液生成蓝色沉淀。)| 编号 | i | ii |
| 实验操作 | 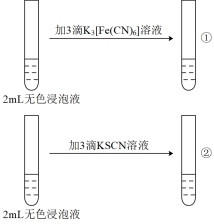 | 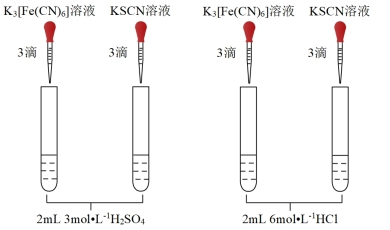 |
| 现象 | ①无蓝色沉淀 ②溶液显红色 | 均无明显现象 |
(5)实验ⅰ中滴加K3[Fe(CN)6]溶液无蓝色沉淀生成,其可能原因是Fe2+的浓度太小,为了验证这一推断,可改进的方法是
(6)实验ⅲ:用10 mL6 mol/L盐酸代替H2SO4浸泡样品后,重复实验ⅰ,发现试管①有蓝色沉淀,试管②溶液显红色,说明Cl-有利于Fe3O4与H+反应,为了验证这一推测,可在用H2SO4溶液浸泡时加入
(7)实验ⅳ:用20 mL6 mol/L盐酸浸泡1.0 g天然磁铁矿粉末,20 min后浸泡液几乎无色,重复实验i,发现试管①、②均无明显现象,与实验iii现象不同的可能原因是
您最近一年使用:0次
2022-05-05更新
|
540次组卷
|
3卷引用:福建省三明市2022届普通高中毕业班下学期5月质量测试化学试题
福建省三明市2022届普通高中毕业班下学期5月质量测试化学试题(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编福建省泉州第一中学2023-2024学年高三上学期12月月考化学试题
9 . 若NA代表阿伏加德罗常数的值,下列说法正确的是
| A.常温下,18gH2O所含的质子数为18NA |
| B.在标准状况下,5.6LCH4和11.2LCl2在光照下充分反应后的分子数为0.75NA |
| C.1L0.1mol·L-1乙二酸溶液中含H+的数目为0.2NA |
| D.用惰性电极电解饱和食盐水,电子转移的数目为NA时,生成的OH-浓度为1mol·L-1 |
您最近一年使用:0次
解题方法
10 . 气体中微量的H2S,对工业生产和环境都有危害。通过以下实验装置利用20%脱硫剂三嗪(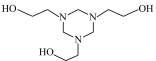 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。

回答下列问题:
(1)仪器1的名称是_______ 。装置甲制取CO2,实验室制取CO2的离子方程式为_______ 。
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是_______ 。
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是_______ ;
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是_______ 。
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为_______ mol·L-1。
(5)三嗪( )水溶液吸收H2S,生成
)水溶液吸收H2S,生成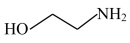 和
和 化学方程式为
化学方程式为_______ 。CuSO4溶液没有出现_______ (填现象), 证明三嗪吸收H2S的化学反应具有_______ 、_______ 等特征,20%三嗪水溶液是很好的脱硫剂。
 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
回答下列问题:
(1)仪器1的名称是
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为
(5)三嗪(
 )水溶液吸收H2S,生成
)水溶液吸收H2S,生成 和
和 化学方程式为
化学方程式为
您最近一年使用:0次
2022-06-14更新
|
282次组卷
|
2卷引用:江西省抚州市2022届高三下学期4月教学质量监测理综化学试题



