名校
1 . 在花瓶中加入“鲜花保鲜剂”能延长鲜花的寿命。
下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是___________(填标号)。
(2)配制一定物质的量浓度的上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、___________ 、___________ 、___________ 。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
(4)“鲜花保鲜剂”中 (阿司匹林中不含
(阿司匹林中不含 )的物质的量浓度为
)的物质的量浓度为___________  。
。
下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 | 质量/g | 摩尔质量/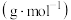 |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
| A.蔗糖 | B.硫酸钾 | C.高锰酸钾 | D.硝酸银 |
(3)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
| A.定容摇匀后,装瓶时有溶液洒出 |
| B.天平砝码有残缺 |
C.容量瓶在使用前刚刚配制完一定物质的量浓度的 溶液而未洗净 溶液而未洗净 |
| D.固体溶解前烧杯中有蒸馏水 |
 (阿司匹林中不含
(阿司匹林中不含 )的物质的量浓度为
)的物质的量浓度为 。
。
您最近一年使用:0次
2021-12-03更新
|
58次组卷
|
2卷引用:陕西省渭滨中学2021-2022学年高一上学期期中考试化学试题
2 . 实验室准备配制3 mol/L的稀硫酸100 mL,请回答下列问题:
(1)需要量取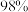 浓硫酸(密度为
浓硫酸(密度为 )
)___________ mL(保留一位小数)。
(2)配制操作可分解成如下几步,正确的操作顺序是:___________ 。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
(3)如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将___________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将___________ ;如果上述D操作中目光俯视,所配溶液的浓度将___________ 。
(1)需要量取
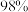 浓硫酸(密度为
浓硫酸(密度为 )
)(2)配制操作可分解成如下几步,正确的操作顺序是:
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
(3)如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将
您最近一年使用:0次
解题方法
3 . 病人输液用的葡萄糖注射液是葡萄糖(化学式为 )的水溶液,其标签上的部分内容如图所示。(已知该溶液密度约为
)的水溶液,其标签上的部分内容如图所示。(已知该溶液密度约为 )
)
(1)该注射液中葡萄糖的物质的量浓度为_______ mol/L(结果精确到0.01)。
(2)某同学进行实验时需要480mL上述葡萄糖溶液,其配制过程如下:
①该同学需称取葡萄糖的质量为_______ g。
②配制时,正确的操作顺序是_______ (用字母表示)。
A.用50mL蒸馏水洗涤烧杯及玻璃棒2~3次,并将洗涤液注入容量瓶中,振荡;
B.用托盘天平准确称取一定量葡萄糖并加入盛有少量水(约50mL)的烧杯中,用玻璃棒慢慢搅拌,使其完全溶解;
C.将已溶解完全的葡萄糖溶液冷却至室温后,玻璃棒注入一定规格的容量瓶中;
D.将容量瓶盖紧,颠倒摇匀;
E.改用胶头滴管加水,至液面恰好与刻度线相切;
F.继续向容量瓶中加水,至液面距容量瓶颈刻度线1~2cm处。
③配制过程中,下列实验操作会对所配溶液物质的量浓度造成什么影响?(填“偏大”、“偏小”或“无影响”)
a.溶解时使用的烧杯和玻璃棒未洗涤_______ ;
b.定容时俯视_______ ;
c.加水超过刻度线后,用胶头滴管吸出多余的液体_______ 。
(3)已知溶液中某溶质的物质的量除以溶剂的质量称为该溶质的质量摩尔浓度,单位为mol/kg。则上述5%葡萄糖注射液的质量摩尔浓度为_______ mol/kg(结果精确到0.01)。
 )的水溶液,其标签上的部分内容如图所示。(已知该溶液密度约为
)的水溶液,其标签上的部分内容如图所示。(已知该溶液密度约为 )
)| 5%葡萄糖注射液 【性状】本品为无色或几乎无色的透明液体,味甜。 【规格】500mL 【贮藏】密闭保存。 |
(2)某同学进行实验时需要480mL上述葡萄糖溶液,其配制过程如下:
①该同学需称取葡萄糖的质量为
②配制时,正确的操作顺序是
A.用50mL蒸馏水洗涤烧杯及玻璃棒2~3次,并将洗涤液注入容量瓶中,振荡;
B.用托盘天平准确称取一定量葡萄糖并加入盛有少量水(约50mL)的烧杯中,用玻璃棒慢慢搅拌,使其完全溶解;
C.将已溶解完全的葡萄糖溶液冷却至室温后,玻璃棒注入一定规格的容量瓶中;
D.将容量瓶盖紧,颠倒摇匀;
E.改用胶头滴管加水,至液面恰好与刻度线相切;
F.继续向容量瓶中加水,至液面距容量瓶颈刻度线1~2cm处。
③配制过程中,下列实验操作会对所配溶液物质的量浓度造成什么影响?(填“偏大”、“偏小”或“无影响”)
a.溶解时使用的烧杯和玻璃棒未洗涤
b.定容时俯视
c.加水超过刻度线后,用胶头滴管吸出多余的液体
(3)已知溶液中某溶质的物质的量除以溶剂的质量称为该溶质的质量摩尔浓度,单位为mol/kg。则上述5%葡萄糖注射液的质量摩尔浓度为
您最近一年使用:0次
名校
解题方法
4 . 某个实验中需0.50 mol·L-1NaOH溶液450 mL和2 mol·L-1硫酸溶液430 mL,根据相关情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______ (填序号),配制上述溶液还需用到的玻璃仪器是__________ (填仪器名称)。
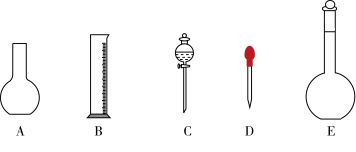
(2)用质量分数为98%、密度为1.84 g·cm-3的浓硫酸配制2 mol·L-1硫酸溶液430 mL,需要浓硫酸的体积为__________ ml。
(3)根据计算用托盘天平称取NaOH的质量为______ g。
(4)在配制一定物质的量浓度的NaOH溶液时,下列选项中会造成所配制溶液浓度偏高的是_____
(1)如图所示的仪器中配制溶液肯定不需要的是

(2)用质量分数为98%、密度为1.84 g·cm-3的浓硫酸配制2 mol·L-1硫酸溶液430 mL,需要浓硫酸的体积为
(3)根据计算用托盘天平称取NaOH的质量为
(4)在配制一定物质的量浓度的NaOH溶液时,下列选项中会造成所配制溶液浓度偏高的是_____
| A.所用NaOH已经潮解 | B.有少量NaOH溶液残留在烧杯里 |
| C.向容量瓶中加水未到刻度线 | D.称量时误用“左码右物” |
您最近一年使用:0次
名校
5 . 某同学欲用浓H2SO4配制480mL0.2mol·L-1的稀H2SO4。
(1)需要用量筒量取98%密度为1.84g·cm-3的浓硫酸___ mL。
(2)配制时,必须使用的仪器有___ (填代号),还缺少的仪器是___ 、___ 。
①烧杯;②10mL量筒;③20mL量筒;④托盘天平(带砝码);⑤玻璃棒
(3)配制过程中出现以下情况,使所配溶液浓度偏高的是____ 。
①容量瓶没有干燥;
②用量筒量取98%的硫酸溶液时仰视;
③溶液转移到容量瓶后,未进行洗涤操作;
④定容时仰视;
⑤如果加水超过了刻度线,取出水使液面恰好到刻度线;
⑥溶解后未冷却就转移到容量瓶
(1)需要用量筒量取98%密度为1.84g·cm-3的浓硫酸
(2)配制时,必须使用的仪器有
①烧杯;②10mL量筒;③20mL量筒;④托盘天平(带砝码);⑤玻璃棒
(3)配制过程中出现以下情况,使所配溶液浓度偏高的是
①容量瓶没有干燥;
②用量筒量取98%的硫酸溶液时仰视;
③溶液转移到容量瓶后,未进行洗涤操作;
④定容时仰视;
⑤如果加水超过了刻度线,取出水使液面恰好到刻度线;
⑥溶解后未冷却就转移到容量瓶
您最近一年使用:0次
2021-10-20更新
|
62次组卷
|
2卷引用:陕西省西安市长安区第一中学2021-2022学年上学期高一10月月考化学试题
6 . 在0.2 L NaCl、MgCl2的混合溶液中,部分离子浓度大小如图所示,回答下列问题:
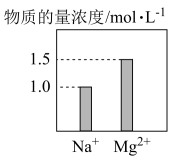
(1)该混合溶液中,Na+的物质的量为_______ mol,Cl-的物质的量为_______ mol。
(2)该混合溶液中含溶质的总质量为_______ g。
(3)将该混合溶液加水稀释至体积为500mL,稀释后溶液中Cl-的物质的量浓度为_______ mol·L-1。
(4)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量的AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为_______ 。

(1)该混合溶液中,Na+的物质的量为
(2)该混合溶液中含溶质的总质量为
(3)将该混合溶液加水稀释至体积为500mL,稀释后溶液中Cl-的物质的量浓度为
(4)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量的AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
您最近一年使用:0次
2021-10-15更新
|
276次组卷
|
3卷引用:陕西省延安市宝塔区河庄坪中学2023-2024学年高一上学期11月期中化学试题
解题方法
7 . 某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置,E为收集气体装置。
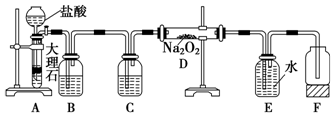
(1)B中盛有溶液___ 。
(2)C中盛放的溶液的目的是___ 。
(3)装置E中有一处错误,请指出___ 。
(4)若反应中总共转移电子e-为0.01mol,请计算产生标准状况下O2多少毫升___ ?至少需要1mol/L盐酸多少毫升?___  写出计算过程
写出计算过程 。
。

(1)B中盛有溶液
(2)C中盛放的溶液的目的是
(3)装置E中有一处错误,请指出
(4)若反应中总共转移电子e-为0.01mol,请计算产生标准状况下O2多少毫升
 写出计算过程
写出计算过程 。
。
您最近一年使用:0次
名校
解题方法
8 . 环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
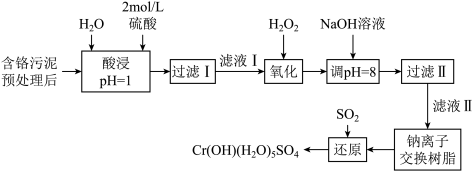
已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)如需配制480 mL酸浸环节所需的硫酸,需要用量筒量取18.4 mol·L-1的浓硫酸___________ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器___________
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O ,写出此反应的离子方程式:
,写出此反应的离子方程式:___________
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因___________
(4)钠离子交换树脂的反应原理为Mn++nNaR MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有___________
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:___________

已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
| 沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O
 ,写出此反应的离子方程式:
,写出此反应的离子方程式:(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O
 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因(4)钠离子交换树脂的反应原理为Mn++nNaR
 MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有(5)请写出流程中用SO2进行还原时发生反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液,应称取______ g NaOH固体;
(2)实验所需的玻璃仪器有:小烧杯、玻璃棒、______ 、______ ;
(3)在本实验中玻璃棒的作用是______________________________ ;
(4)下列配制的溶液浓度偏低的是:_________ ;
A.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
B.定容时俯视刻度线
C.配制时溶液未经冷却就转移至容量瓶中
D.配制前容量瓶中有少量蒸馏水
E.定容后经振荡、摇匀,发现液面下降,再加适量的蒸馏水至刻度线
(5)用质量分数98%浓硫酸、密度1.84g/mL的浓硫酸配制0.5mol/L的稀硫酸500mL,需要浓硫酸体积为______ mL。
(1)配制250mL 1.25mol/L的NaOH溶液,应称取
(2)实验所需的玻璃仪器有:小烧杯、玻璃棒、
(3)在本实验中玻璃棒的作用是
(4)下列配制的溶液浓度偏低的是:
A.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
B.定容时俯视刻度线
C.配制时溶液未经冷却就转移至容量瓶中
D.配制前容量瓶中有少量蒸馏水
E.定容后经振荡、摇匀,发现液面下降,再加适量的蒸馏水至刻度线
(5)用质量分数98%浓硫酸、密度1.84g/mL的浓硫酸配制0.5mol/L的稀硫酸500mL,需要浓硫酸体积为
您最近一年使用:0次
解题方法
10 . (1)某学生用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL1mol/L的稀硫酸。其实验过程如下:
①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为_______ ;
②配制稀硫酸时所需要浓硫酸体积为_______ mL,用_______ 量筒(“100 mL”或 “10 mL”)量取浓硫酸;
③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌;
④将____________ 的上述溶液沿玻璃棒注入100 mL的容量瓶中,并用50mL蒸馏水分2~3次洗涤烧杯,洗涤液也注入容量瓶中,并摇匀;
⑤加水至距刻度线1~2cm时,改用_____________ 加水,使溶液凹液面跟刻度相平。
(2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为__________ (列出计算式即可)。(已知:浓硫酸的质量分数为98%,密度为1.84 g/cm3)
①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为
②配制稀硫酸时所需要浓硫酸体积为
③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌;
④将
⑤加水至距刻度线1~2cm时,改用
(2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为
您最近一年使用:0次



