2020高三·全国·专题练习
1 . 设NA是阿伏加 德罗常数的值。下列说法正确的是( )
A.500mL2mol∙L-1FeCl3溶液中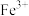 数为NA 数为NA |
| B.电解法精炼铜,阴极析出1molCu时,阳极失去的电子数等于2NA |
| C.64gSO2与足量的O2在一定条件下反应生成的SO3分子数为NA |
D.在标准状况下,2.24LNH3通入水中制成氨水, 数等于0.1NA 数等于0.1NA |
您最近一年使用:0次
2 . 设NA为阿伏加 德罗常数,下列说法正确的是
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1L 2mol/L的AlCl3溶液中含氯离子为6 NA
④标准状况下,22.4LHF中分子数为NA
⑤32gO2和O3混合气体中含有原子数为2 NA
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1L 2mol/L的AlCl3溶液中含氯离子为6 NA
④标准状况下,22.4LHF中分子数为NA
⑤32gO2和O3混合气体中含有原子数为2 NA
| A.①②③⑤ | B.①②③④ | C.①③④⑤ | D.②③④⑤ |
您最近一年使用:0次
2020-08-27更新
|
226次组卷
|
4卷引用:甘肃省天水市第一中学2021届高三上学期第一次考试化学试题
名校
解题方法
3 . 海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”(假设盐分以一个NaCl计),其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
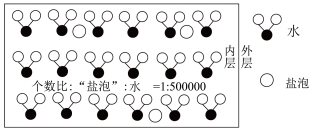

| A.海冰内层“盐泡”越多,密度越小 |
| B.海冰冰龄越长,内层的“盐泡”越少 |
| C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在 |
| D.海冰内层NaCl的浓度约为10-4mol/L(设冰的密度为0.9g/cm3) |
您最近一年使用:0次
2020-08-20更新
|
1182次组卷
|
3卷引用:湖南省郴州市2021届高三上学期第一次质检化学试题
4 . 标准状况下,向多份等量的NaOH固体中,分别加入一定体积的1.00mol/L (NH4)2Fe(SO4)2溶液充分反应,反应产生的NH3随(NH4)2Fe(SO4)2溶液体积的变化如图所示(假设生成的NH3全部逸出):
(1)a的值为_______ L。
(2)每份NaOH固体的物质的量_______ mol(写出计算过程)。

(1)a的值为
(2)每份NaOH固体的物质的量
您最近一年使用:0次
5 . 为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理: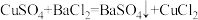
实验步骤:
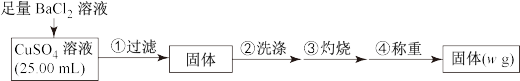
(1)判断 沉淀完全的操作为
沉淀完全的操作为____________ 。
(2)步骤②判断沉淀是否洗净所选用的试剂为_____________ 。
(3)步骤③灼烧时盛装样品的仪器名称为__________ 。
(4)固体质量为wg,则c(CuSO4)=________ mol‧L-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_________ (填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理: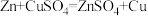 ,
,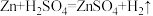
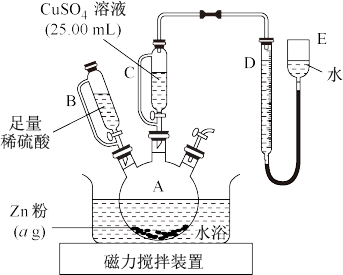
实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为___________ 。
(7)步骤⑥需保证体系恢复到室温的原因是________ (填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下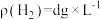 ,则c(CuSO4)
,则c(CuSO4)______ mol‧L-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)________ (填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:_________ (填“是”或“否”)。
Ⅰ.甲方案
实验原理:
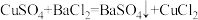
实验步骤:
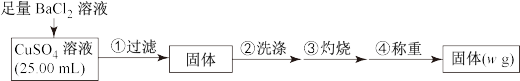
(1)判断
 沉淀完全的操作为
沉淀完全的操作为(2)步骤②判断沉淀是否洗净所选用的试剂为
(3)步骤③灼烧时盛装样品的仪器名称为
(4)固体质量为wg,则c(CuSO4)=
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)
Ⅱ.乙方案
实验原理:
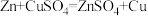 ,
,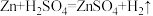

实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为
(7)步骤⑥需保证体系恢复到室温的原因是
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下
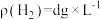 ,则c(CuSO4)
,则c(CuSO4)(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:
您最近一年使用:0次
2020-07-11更新
|
7832次组卷
|
28卷引用:2020年天津卷化学高考真题变式题13-16
(已下线)2020年天津卷化学高考真题变式题13-162020年天津卷化学高考试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编(已下线)第29讲 化学实验方案的设计与评价-2021年高考化学一轮复习名师精讲练(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测四川省成都市石室中学2020-2021学年高一上学期10月阶段性测试化学试题(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)重点3 实验探究分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)重点7 探究型实验综合题-2021年高考化学专练【热点·重点·难点】(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)天津市塘沽一中2022届高三上学期毕业班开学调研考试化学试题河南省信阳高级中学2021-2022学年高一上学期12月月考化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第十章 化学综合实验 第64讲 物质的检测综合实验探究(已下线)题型50 物质含量测定型综合实验(已下线)04 定量分析型综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型48 物质含量测定型综合实验(已下线)专题19 实验综合题(已下线)考点07 物质的量浓度(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第17讲实验方案的设计与评价(已下线)微专题以物质含量或组成测定为主的综合实验天津市第八中学2023-2024学年高三上学期第一次大单元教学(9月月考)化学试题
6 .  为阿伏加 德罗常数的值。下列说法正确的是
为阿伏加 德罗常数的值。下列说法正确的是
 为阿伏加 德罗常数的值。下列说法正确的是
为阿伏加 德罗常数的值。下列说法正确的是A.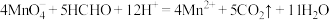 , ,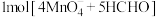 完全反应转移的电子数为 完全反应转移的电子数为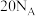 |
B.用电解粗铜的方法精炼铜,当电路中通过的电子数为 时,阳极应有 时,阳极应有 转化为 转化为 |
C.常温下, 的 的 溶液中,水电离出的 溶液中,水电离出的 数为 数为 |
D.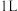 浓度为 浓度为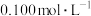 的 的 溶液中,阴离子数为 溶液中,阴离子数为 |
您最近一年使用:0次
2020-07-11更新
|
8178次组卷
|
32卷引用:2020年浙江省高考化学试卷(7月选考)
2020年浙江省高考化学试卷(7月选考)(已下线)专题02 化学计量与化学计算-2020年高考真题和模拟题化学分项汇编(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)吉林松原市油田第十一中学2021届高三第二次阶段考试化学试题浙江省绍兴市第一中学2023-2024学年高三首考模拟考试化学试题(已下线)热点3 阿伏加德罗常数-2021年高考化学专练【热点·重点·难点】(已下线)热点4 化学计量及其应用-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)专题02 化学用语及常用物理量——备战2021年高考化学纠错笔记(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)重点4 阿伏加德罗常数-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)课时13 阿伏加德罗常数运用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向01 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点微专题 (已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(一) 阿伏加德罗常数的突破(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)甘肃省嘉峪关市第一中学2021届高三下学期六模考试理综化学试题(已下线)第一单元 化学计量在实验中的应用(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)专题13.阿伏加德罗常数-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用) 浙江省金丽衢十二校2021-2022学年高三上学期第一次联考化学试题(已下线)专题01 阿伏加德罗常数正误判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题02 NA及其应用—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)微专题03 破解“七陷阱”突破NA-备战2023年高考化学一轮复习考点微专题(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题河南省洛阳市新安县第一高级中学2022-2023学年高三上学期入学测试(实验小班)化学试题(已下线)题型4 阿伏伽德罗常数的综合应用-高考必备50个题型(已下线)专题03 阿伏伽德罗常数的应用(已下线)考点06 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西省吕梁市兴县2023-2024学年高三上学期9月月考化学试题
7 . 设 NA 为阿伏加 德罗常数的数值。下列说法正确的是
| A.常温下,5.6g 铁粉投入足量的浓硝酸中,转移电子数为 0.3NA |
B.0.5mol 环氧乙烷( )中含有的共价键数目为 1.5NA )中含有的共价键数目为 1.5NA |
| C.2.4g 镁条在足量的N2与O2的混合气体中完全燃烧,转移电子数为 0.2NA |
| D.25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA |
您最近一年使用:0次
8 . NA表示阿伏加 德罗常数的值。下列叙述正确的是( )
| A.在0.1mol·L-1的Na2CO3溶液中,阴离子总数一定大于0.1NA |
| B.常温常压下,由32gO2与O3组成的混合气体中含有的分子总数小于NA |
| C.36.0gCaO2与足量水完全反应,转移的电子数为NA |
| D.1molCH4与1molCl2混合,充分反应后,生成气体分子数为NA |
您最近一年使用:0次
2020-06-28更新
|
194次组卷
|
2卷引用:广西来宾市2020届高三5月教学质量诊断性联合考试理综化学试题
9 . 用NA表示阿伏加 德罗常数的值,下列说法不正确的是( )
| A.常温下,10.6gC8H10和C4H10O3的混合物中氢原子数为NA |
| B.标准状况下,22.4LC2H4和CH3OCH3的混合气体完全燃烧转移的电子数目为12NA |
| C.只含有BaSO4[Ksp(BaSO4)=1.0×10-10]的悬浊液中,离子总数是2.0×10-5NA |
| D.室温下,pH=11,体积为1L的NaAlO2溶液中,发生电离的水分子数为1.0×10-3NA |
您最近一年使用:0次
10 . 已知粗盐水中含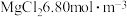 ,含
,含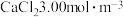 。向粗盐水中加入
。向粗盐水中加入 除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入
除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入 除
除 。
。
(1)处理上述粗盐水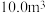 ,至少需要加
,至少需要加
________  。(保留三位有效数字)
。(保留三位有效数字)
(2)如果用碳酸化尾气(含 体积分数为0.100、
体积分数为0.100、 体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2
体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2 。处理上述
。处理上述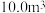 粗盐水至少需要通入标准状况下
粗盐水至少需要通入标准状况下________ 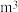 碳酸化尾气。(需列式计算,保留三位有效数字)
碳酸化尾气。(需列式计算,保留三位有效数字)
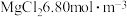 ,含
,含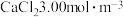 。向粗盐水中加入
。向粗盐水中加入 除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入
除Mg2+:MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2。然后加入 除
除 。
。(1)处理上述粗盐水
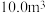 ,至少需要加
,至少需要加
 。(保留三位有效数字)
。(保留三位有效数字)(2)如果用碳酸化尾气(含
 体积分数为0.100、
体积分数为0.100、 体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2
体积分数0.0400)代替碳酸钠,发生如下反Ca2++2NH3+CO2+H2O→CaCO3↓+2 。处理上述
。处理上述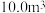 粗盐水至少需要通入标准状况下
粗盐水至少需要通入标准状况下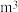 碳酸化尾气。(需列式计算,保留三位有效数字)
碳酸化尾气。(需列式计算,保留三位有效数字)
您最近一年使用:0次



