名校
1 . 工业烟气含有 ,可以用
,可以用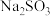 溶液进行绿色化处理后再排放。设
溶液进行绿色化处理后再排放。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 ,可以用
,可以用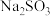 溶液进行绿色化处理后再排放。设
溶液进行绿色化处理后再排放。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.6.4 g  含有的电子数目为0.3 含有的电子数目为0.3 |
B.1 L 1  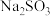 溶液中 溶液中 的数目为2 的数目为2 |
C.22.4 L (标准状况)与足量氧气反应,转移电子数目为2 (标准状况)与足量氧气反应,转移电子数目为2 |
D.1 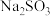 溶液最多能吸收 溶液最多能吸收 的数目为0.1 的数目为0.1 |
您最近一年使用:0次
2023-02-27更新
|
1552次组卷
|
7卷引用:广东省广州市等3地东莞市东华松山湖高级中学有限公司等2校2023届高三下学期一模化学试题
解题方法
2 . 硫酸锰可为动植物提供微量元素,还可用作工业催化剂等。用 还原
还原 可制备硫酸锰,装置如图所示(夹持装置已省略)。
可制备硫酸锰,装置如图所示(夹持装置已省略)。
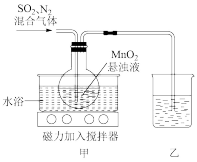
回答下列问题:
(1)实验室中常用70%的浓硫酸和 制备
制备 ,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为
,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为 )
)_______ mL(保留一位小数)来配制。这种方法制备 的化学方程式为
的化学方程式为_______ 。
(2)实验中通入 的作用是
的作用是_______ 。
(3)装置甲为制备 的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是
的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是_______ 。
(4)装置甲中 还原
还原 的离子方程式是
的离子方程式是_______ 。
(5)装置乙的作用是防止 逸出对实验者造成毒害,则该装置中的试剂是
逸出对实验者造成毒害,则该装置中的试剂是_______ 。
(6)若检测到制备后的溶液中 ,原因可能是
,原因可能是_______ 。
 还原
还原 可制备硫酸锰,装置如图所示(夹持装置已省略)。
可制备硫酸锰,装置如图所示(夹持装置已省略)。
回答下列问题:
(1)实验室中常用70%的浓硫酸和
 制备
制备 ,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为
,若该制备实验中需70%的浓硫酸49g,则需98%的浓硫酸(浓度为 )
) 的化学方程式为
的化学方程式为(2)实验中通入
 的作用是
的作用是(3)装置甲为制备
 的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是
的装置,采用水浴加热,而不是采用酒精灯明火加热。相比酒精灯加热,水浴加热的主要优点是(4)装置甲中
 还原
还原 的离子方程式是
的离子方程式是(5)装置乙的作用是防止
 逸出对实验者造成毒害,则该装置中的试剂是
逸出对实验者造成毒害,则该装置中的试剂是(6)若检测到制备后的溶液中
 ,原因可能是
,原因可能是
您最近一年使用:0次
2023-01-14更新
|
134次组卷
|
3卷引用:海南省屯昌县2023届高三二模统考(A)化学试题
名校
解题方法
3 . 下列有关物质的量浓度和质量分数的计算正确的是
| A.98%的浓硫酸的物质的量浓度大于49%的硫酸的物质的量浓度的二倍 |
| B.20%的氢氧化钠溶液和30%的氢氧化钠溶液等体积混合,混合后溶液的溶质质量分数大于25% |
C. , ,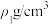 的硫酸溶液与 的硫酸溶液与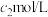 , ,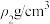 的硫酸溶液等体积混合,得到 的硫酸溶液等体积混合,得到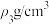 的硫酸溶液的浓度为 的硫酸溶液的浓度为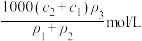 |
D.25℃时 饱和溶液(密度为 饱和溶液(密度为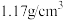 )的物质的量浓度约为5.3mol/L(已知25℃时氯化钠在水中的溶解度为36克) )的物质的量浓度约为5.3mol/L(已知25℃时氯化钠在水中的溶解度为36克) |
您最近一年使用:0次
2022-12-25更新
|
434次组卷
|
2卷引用:重庆缙云教育联盟2023届高三二模考试化学试题
4 . 设NA为阿伏加德罗常数的值,关于反应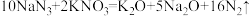 ,下列说法正确的是
,下列说法正确的是
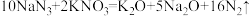 ,下列说法正确的是
,下列说法正确的是A.生成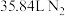 时,转移的电子数为NA 时,转移的电子数为NA |
B.等物质的量的 和 和 中所含阴离子数均为NA 中所含阴离子数均为NA |
| C.当氧化产物比还原产物多7mol时,转移的电子数为5NA |
D.含NA个 的 的 溶解于1L水中,所得溶液中 溶解于1L水中,所得溶液中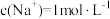 |
您最近一年使用:0次
2022-12-16更新
|
472次组卷
|
7卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
名校
5 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.28g乙烯和丙烯的混合气体中含有的碳原子数为2 |
B.1.8g重水 中所含质子数为 中所含质子数为 |
C.电解粗铜精炼铜,通过电路的电子数为 时,阳极有32g Cu转化为 时,阳极有32g Cu转化为 |
D.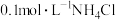 溶液中, 溶液中, 、 、 数目之和为0.1 数目之和为0.1 |
您最近一年使用:0次
2022-11-04更新
|
532次组卷
|
8卷引用:湖南省常德市第一中学2023届高三模拟预测化学试题
名校
解题方法
6 . 下列说法不正确的是
| A.把7.2 g纯铁粉加入40 mL浓度未知的HNO3溶液中,充分反应后剩余固体1.6 g,产生NO2和NO的混合气体0.08 mol,若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度为7.0 mol·L-1 |
| B.将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4溶液蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是c2>2c1 |
C.将标准状况下的a L HCl气体溶于1 000 mL水中,得到的盐酸溶液密度为b g·mL-1,则该盐酸溶液的物质的量浓度为 mol·L-1 mol·L-1 |
D.V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中 的物质的量浓度为 的物质的量浓度为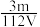 mol·L-1 mol·L-1 |
您最近一年使用:0次
2022-08-05更新
|
636次组卷
|
7卷引用:浙江省东阳中学2023届高三浙江省普通高校招生选考科目考试仿真训练化学试题
浙江省东阳中学2023届高三浙江省普通高校招生选考科目考试仿真训练化学试题甘肃省天水市第一中学2021届高三上学期第一次考试化学试题(已下线)考点07 物质的量浓度(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)甘肃省天水市第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第一章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)专题09 物质的量-备战2023年高考化学母题题源解密(广东卷)新疆和田地区墨玉县2022-2023学年高三上学期11月期中考试化学试题
7 .  为阿伏加 德罗常数的值。下列说法正确的是
为阿伏加 德罗常数的值。下列说法正确的是
 为阿伏加 德罗常数的值。下列说法正确的是
为阿伏加 德罗常数的值。下列说法正确的是A.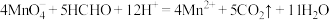 , ,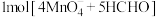 完全反应转移的电子数为 完全反应转移的电子数为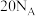 |
B.用电解粗铜的方法精炼铜,当电路中通过的电子数为 时,阳极应有 时,阳极应有 转化为 转化为 |
C.常温下, 的 的 溶液中,水电离出的 溶液中,水电离出的 数为 数为 |
D.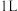 浓度为 浓度为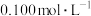 的 的 溶液中,阴离子数为 溶液中,阴离子数为 |
您最近一年使用:0次
2020-07-11更新
|
8181次组卷
|
32卷引用:浙江省绍兴市第一中学2023-2024学年高三首考模拟考试化学试题
浙江省绍兴市第一中学2023-2024学年高三首考模拟考试化学试题(已下线)题型4 阿伏伽德罗常数的综合应用-高考必备50个题型(已下线)专题03 阿伏伽德罗常数的应用(已下线)考点06 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西省吕梁市兴县2023-2024学年高三上学期9月月考化学试题2020年浙江省高考化学试卷(7月选考)(已下线)专题02 化学计量与化学计算-2020年高考真题和模拟题化学分项汇编(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)吉林松原市油田第十一中学2021届高三第二次阶段考试化学试题(已下线)热点3 阿伏加德罗常数-2021年高考化学专练【热点·重点·难点】(已下线)热点4 化学计量及其应用-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)专题02 化学用语及常用物理量——备战2021年高考化学纠错笔记(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)重点4 阿伏加德罗常数-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)课时13 阿伏加德罗常数运用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向01 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点微专题 (已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(一) 阿伏加德罗常数的突破(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)甘肃省嘉峪关市第一中学2021届高三下学期六模考试理综化学试题(已下线)第一单元 化学计量在实验中的应用(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)专题13.阿伏加德罗常数-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用) 浙江省金丽衢十二校2021-2022学年高三上学期第一次联考化学试题(已下线)专题01 阿伏加德罗常数正误判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题02 NA及其应用—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)微专题03 破解“七陷阱”突破NA-备战2023年高考化学一轮复习考点微专题(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题河南省洛阳市新安县第一高级中学2022-2023学年高三上学期入学测试(实验小班)化学试题
8 . 某同学购买了一瓶“84消毒液”,包装说明如下:
根据以上信息和相关知识判断,下列分析不正确的是
| 主要成分:25%NaClO、1000mL、密度1.19g·cm-3 使用方法:稀释100倍 体积比 后使用 注意事项:密封保存,易吸收空气中的CO2变质 |
| A.该“84消毒液”的物质的量浓度约为4.0mol·L-1 |
| B.一瓶该“84消毒液”能吸收空气中44.8L的CO2(标准状况)而完全变质 |
| C.取100mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04mol·L-1 |
| D.参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含25% NaClO的消毒液,需要称量的NaClO固体质量为149g |
您最近一年使用:0次
2019-11-23更新
|
293次组卷
|
3卷引用:重庆市缙云教育联盟2023-2024学年高三上学期模拟预测化学试题
名校
9 . 欲配制100 mL 1.0 mol·L-1硫酸钠溶液,不正确的方法是
| A.将14.2 g 硫酸钠溶于100 mL水中 |
| B.将32.2 g Na2SO4·10H2O溶于少量水中,再加水稀释至100 mL |
| C.将20 mL 5.0 mol·L-1硫酸钠溶液用水稀释至100 mL |
| D.将14.2 g 硫酸钠溶于水中得到100 mL溶液 |
您最近一年使用:0次
2018-12-19更新
|
374次组卷
|
7卷引用:辽宁省沈阳市浑南区东北育才学校2023届高三一模化学试题



