1 . Ⅰ.人们每天都要摄入大量的淀粉类物质,以维持机体的营养均衡。这是因为淀粉[化学式为(C6H10O5)n]在淀粉酶作用下或在酸性环境下可以水解成葡萄糖[化学式是C6H12O6],请回答下列问题:
(1)淀粉的摩尔质量为______________ ;
(2)将90 g葡萄糖溶于水,配成1 L溶液,所得溶液溶质的物质的量浓度为________ ;
(3)把淀粉溶于沸水中,制成淀粉溶液,回答下列问题。
①如何通过实验证明淀粉溶液是胶体:______________ (填现象名称)。
②在淀粉溶液中加入少量氯化钠晶体,并装入半透膜袋,系紧袋口,把它悬挂在盛有蒸馏水的烧杯里充分反应。能从半透膜里析出的分散质的化学式是____________ ,该操作的名称是____________ 。
Ⅱ.食品安全关系着国民生计,影响食品安全的因素很多。
(1)丁苯橡胶的结构简式如图所示: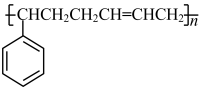 ,它是由
,它是由________ (写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH=CH—CH2—CH=CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________ 。
A.分子式为C18H34O2B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应D.能使酸性KMnO4溶液褪色
(1)淀粉的摩尔质量为
(2)将90 g葡萄糖溶于水,配成1 L溶液,所得溶液溶质的物质的量浓度为
(3)把淀粉溶于沸水中,制成淀粉溶液,回答下列问题。
①如何通过实验证明淀粉溶液是胶体:
②在淀粉溶液中加入少量氯化钠晶体,并装入半透膜袋,系紧袋口,把它悬挂在盛有蒸馏水的烧杯里充分反应。能从半透膜里析出的分散质的化学式是
Ⅱ.食品安全关系着国民生计,影响食品安全的因素很多。
(1)丁苯橡胶的结构简式如图所示:
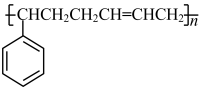 ,它是由
,它是由(2)劣质植物油中的亚油酸[CH3(CH2)4—CH=CH—CH2—CH=CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是
A.分子式为C18H34O2B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应D.能使酸性KMnO4溶液褪色
您最近一年使用:0次
名校
解题方法
2 . 海带中既含有有机碘化合物又含有碘化钠等无机碘化合物。某课题组探究了海带提碘的优化条件,并用色度计测定了某海带样品中碘的含量。实验步骤:
I.预处理:将干海带刷净,剪成 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。
II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到 烧杯中,加入
烧杯中,加入 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。
IV.氧化:向滤液中加入稀 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。
V.萃取:向分液漏斗中加入 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。
VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以 的形式存在。
的形式存在。
回答下列问题:
(1)第II步中的仪器A是___________ 。
(2)证明第III步滤液中存在 的实验方法是
的实验方法是___________ ,实验现象是___________ 。
(3)第IV步氧化过程中发生反应的离子方程式为___________ 。
(4)第V步可得到 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
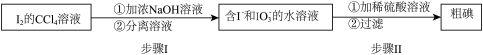
请写出步骤II的离子方程式:___________ 。
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(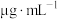 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ 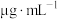 。
。
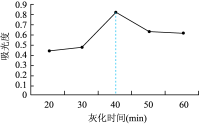
(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。
I.预处理:将干海带刷净,剪成
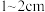 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到
 烧杯中,加入
烧杯中,加入 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。IV.氧化:向滤液中加入稀
 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。V.萃取:向分液漏斗中加入
 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的
 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以
 的形式存在。
的形式存在。回答下列问题:
(1)第II步中的仪器A是
(2)证明第III步滤液中存在
 的实验方法是
的实验方法是(3)第IV步氧化过程中发生反应的离子方程式为
(4)第V步可得到
 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
请写出步骤II的离子方程式:
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(
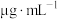 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是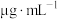 。
。(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是

您最近一年使用:0次
2023-07-03更新
|
149次组卷
|
2卷引用:山西省运城市2022-2023学年高一下学期期末考试化学试题
解题方法
3 . 氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用下图所示装置探究氨气的有关性质(已知:氨气不溶于 溶液)(夹持装置省略)。
溶液)(夹持装置省略)。

回答下列问题:
(1)实验室制取 的化学方程式为
的化学方程式为_______ ,装置B的作用是_______ 。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先进行的操作是_______ (填字母)。
a.加热装置A b.加热装置C
(3)实验中观察到装置C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则装置C中发生反应的化学方程式为_______ ,该反应证明氨气具有_______ 性。
(4)该实验缺少尾气吸收装置,下图中能用来吸收尾气的装置是_______ (填序号)。
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,则所得溶液中溶质的物质的量浓度为_______  。
。
 溶液)(夹持装置省略)。
溶液)(夹持装置省略)。
回答下列问题:
(1)实验室制取
 的化学方程式为
的化学方程式为(2)连接好装置并检验装置的气密性后,装入药品,然后应先进行的操作是
a.加热装置A b.加热装置C
(3)实验中观察到装置C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则装置C中发生反应的化学方程式为
(4)该实验缺少尾气吸收装置,下图中能用来吸收尾气的装置是
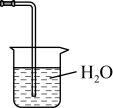 |  |  |
| Ⅰ | Ⅱ | Ⅲ |
 。
。
您最近一年使用:0次
2022-05-19更新
|
204次组卷
|
3卷引用:辽宁省辽西联合校2021-2022学年高一下学期期中考试化学试题
名校
解题方法
4 . 氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有关性质。

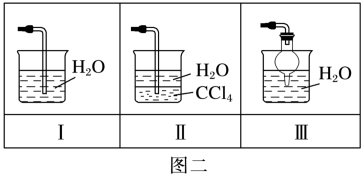
(1)装置A中烧瓶内试剂可选用_______ (填序号),B的作用是_______ 。
a.碱石灰b.浓硫酸c.生石灰d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_____ (填I或II)。
I.打开旋塞逐滴向圆底烧瓶中加入氨水II.加热装置C
(3)装置C中反应相关化学方程式为_____ ,该反应证明氨气具有____ 性;实验中观察到C____ ,D中____ 。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_______ (填装置序号)。
(5)氨气极易溶于水,若标准状况下,将 的氨气溶于水配成
的氨气溶于水配成 溶液,所得溶液的物质的量浓度为
溶液,所得溶液的物质的量浓度为_______ mol/L。


(1)装置A中烧瓶内试剂可选用
a.碱石灰b.浓硫酸c.生石灰d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先
I.打开旋塞逐滴向圆底烧瓶中加入氨水II.加热装置C
(3)装置C中反应相关化学方程式为
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是
(5)氨气极易溶于水,若标准状况下,将
 的氨气溶于水配成
的氨气溶于水配成 溶液,所得溶液的物质的量浓度为
溶液,所得溶液的物质的量浓度为
您最近一年使用:0次
名校
解题方法
5 . 现采用加热熟石灰与氯化铵的混合物的方法在实验室制备氨气,并进行有关氨气的性质实验。_____ 。
(2)B中盛放的试剂名称为_________ 。
(3)将D装置置于C处收集氨气,其中a口接______ (填“c”或“d”,下同),b口接_____ 。
(4)E中倒置漏斗的作用为_______ 。
(5)取下D装置,证明氨气已集满的操作和现象分别是___________ 。
(6)利用下图进喷泉实验。_____________ 。
②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为_______ 。

(2)B中盛放的试剂名称为
(3)将D装置置于C处收集氨气,其中a口接
(4)E中倒置漏斗的作用为
(5)取下D装置,证明氨气已集满的操作和现象分别是
(6)利用下图进喷泉实验。

②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为
您最近一年使用:0次
2021-06-23更新
|
222次组卷
|
3卷引用:河南省非凡吉创2020-2021学年高一下学期5月调研化学试题
名校
6 . 下列说法不正确的是
A.某硝酸密度为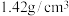 ,质量分数为 ,质量分数为 ,此硝酸物质的量浓度为 ,此硝酸物质的量浓度为 |
B.将物质的量浓度为 、质量分数为 、质量分数为 的硫酸溶液,加水稀释至物质的量浓度为 的硫酸溶液,加水稀释至物质的量浓度为 ,质量分数变为 ,质量分数变为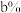 ,则 ,则 |
C. 溶液和 溶液和 溶液, 溶液, 的物质的量不同 的物质的量不同 |
D. 溶液中含 溶液中含 ,则溶液中的 ,则溶液中的 物质的量浓度为 物质的量浓度为 |
您最近一年使用:0次
名校
7 . NA表示阿伏加德罗常数的值。下列说法错误的是
| A.标况下,3.36L氮气所含共用电子对的数目为0.45NA |
B.0.2mol 与水恰好完全反应转移0.4mol电子 与水恰好完全反应转移0.4mol电子 |
C.1.8g的NH 中含有的电子数为1NA 中含有的电子数为1NA |
D.1 L 0.1 mol/L的 溶液中, 溶液中, 的物质的量为 的物质的量为 |
您最近一年使用:0次
名校
解题方法
8 . 微观探析是认识物质的一种途径。设 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是
 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是A.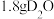 中含有的中子数目为 中含有的中子数目为 |
B.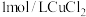 溶液中含有 溶液中含有 的数目小于 的数目小于 |
C.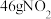 与 与 的混合物中含有的分子数为 的混合物中含有的分子数为 |
D.25℃,101kPa, 与NaOH溶液完全反应,转移电子数目为 与NaOH溶液完全反应,转移电子数目为 |
您最近一年使用:0次
2024-03-06更新
|
873次组卷
|
4卷引用:2024届广东省汕头市高三下学期一模化学试题
名校
解题方法
9 . 在标准状况下,一支50mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器。设空气中氧气的体积分数为20%,下列说法错误的是

| A.振荡后注射器活塞不移动 |
| B.打开弹簧夹,快速吸入15mL空气后夹上弹簧夹,充分振荡注射器,活塞停留在大约33mL处,所得溶液物质的量浓度约为0.036mol/L |
| C.若将20mLNO换为NO2,完全反应需吸入约20mL空气 |
| D.若注射器中是5mLNO和15mLNO2的混合气体,吸入5mL水后充分振荡注射器,活塞停留在大约15mL处 |
您最近一年使用:0次
名校
解题方法
10 . 下列说法中,正确的是
| A.16gO2物质的量为1mol |
| B.常温常压下,1molN2的体积是22.4L |
| C.Mg的摩尔质量是24g/mol |
| D.0.1mol/LBa(OH)2溶液中含有0.2molOH- |
您最近一年使用:0次



