1 . 国际化学年的中国宣传口号是“化学——我们的生活,我们的未来”。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:_______ 。
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:_______ 。
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
(4)化学实验中,若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。
①在如下图所示步骤中,发生氧化反应的是_______ (填序号,下同),发生还原反应的是_______ ,既没发生氧化反应又没发生还原反应的是_______ 。(提示:铬元素的化合价有+6、+3)_______ 。
_______K2Cr2O7+_______HCl=_______Cl2↑+_______KCl+_______CrCl3+_______
(5)已知方程式F:KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑。
①请用双线桥法标出电子转移的方向和数目_______ 。
②上述反应中氧化产物和还原产物的质量比为_______ 。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:
(4)化学实验中,若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。
①在如下图所示步骤中,发生氧化反应的是
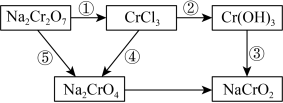
_______K2Cr2O7+_______HCl=_______Cl2↑+_______KCl+_______CrCl3+_______
(5)已知方程式F:KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑。
①请用双线桥法标出电子转移的方向和数目
②上述反应中氧化产物和还原产物的质量比为
您最近一年使用:0次
解题方法
2 . 化学与生产、生活有着密切的联系.根据所学知识回答下列问题
(1)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝及其化合物在下列场合使用时必须严格加以控制的是_______ (填字母)
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔
(2)_______ (填化学式)可用于呼吸面具或潜艇中的氧气来源
(3)盛装 溶液的试剂瓶不能用玻璃塞的原因是
溶液的试剂瓶不能用玻璃塞的原因是_______ (用化学方程式表示)
(4)当人体缺铁时,往往需要吃补铁保健品,人体能够吸收的是 ,但
,但 很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是
很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是_______ (写出操作过程、现象及结论)
(5)胃舒平[主要成分为 ]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式
]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式_______
(6) 是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验
是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验 是否泄漏的反应方程式为
是否泄漏的反应方程式为 ,若反应中消耗
,若反应中消耗 ,则被氧化的
,则被氧化的 的体积为
的体积为_______ L(标准状况下)
(1)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝及其化合物在下列场合使用时必须严格加以控制的是
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔
(2)
(3)盛装
 溶液的试剂瓶不能用玻璃塞的原因是
溶液的试剂瓶不能用玻璃塞的原因是(4)当人体缺铁时,往往需要吃补铁保健品,人体能够吸收的是
 ,但
,但 很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是
很容易被氧化.检验某固体补铁剂中铁元素是否被氧化的方法是(5)胃舒平[主要成分为
 ]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式
]是一种治疗胃酸过多的药物,写出胃舒平与胃酸反应的离子方程式(6)
 是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验
是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂检验 是否泄漏的反应方程式为
是否泄漏的反应方程式为 ,若反应中消耗
,若反应中消耗 ,则被氧化的
,则被氧化的 的体积为
的体积为
您最近一年使用:0次
名校
3 . ①液态醋酸;②液氨;③Ba(OH)2溶液;④熔融AlCl3;⑤Fe(OH)3胶体;⑥镁;⑦CO2;⑧HI溶液;⑨蔗糖(C12H22O11)
(1)以上物质中属于电解质的是_______ (填序号);以上纯净物中能导电的是_______ (填序号)。
(2)写出⑥⑦反应的化学方程式:________ 。
(3)将34.2g蔗糖完全燃烧后的产物通过足量Na2O2,Na2O2增重_______ 34.2g(填“>”、“<”或“=”)。
(4)写出⑤和足量⑧反应的离子方程式________ 。
(1)以上物质中属于电解质的是
(2)写出⑥⑦反应的化学方程式:
(3)将34.2g蔗糖完全燃烧后的产物通过足量Na2O2,Na2O2增重
(4)写出⑤和足量⑧反应的离子方程式
您最近一年使用:0次
名校
4 . 对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:① ②Cu ③NaCl ④
②Cu ③NaCl ④ 胶体 ⑤乙醇 ⑥CO2 ⑦稀硫酸
胶体 ⑤乙醇 ⑥CO2 ⑦稀硫酸
(1)以上物质中属于混合物的是_______ (填序号,下同),属于电解质的是_______ 。
(2)向④中逐滴滴加⑦,可观察到的现象是_______ 。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是_______ (填字母)。

(4)有同学认为所有酸碱中和反应均可表示为 。请举个例子反驳上述观点(用化学方程式表示)
。请举个例子反驳上述观点(用化学方程式表示)_______ 。
Ⅰ.现有以下物质:①
 ②Cu ③NaCl ④
②Cu ③NaCl ④ 胶体 ⑤乙醇 ⑥CO2 ⑦稀硫酸
胶体 ⑤乙醇 ⑥CO2 ⑦稀硫酸(1)以上物质中属于混合物的是
(2)向④中逐滴滴加⑦,可观察到的现象是
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(4)有同学认为所有酸碱中和反应均可表示为
 。请举个例子反驳上述观点(用化学方程式表示)
。请举个例子反驳上述观点(用化学方程式表示)
您最近一年使用:0次
名校
5 . 正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为_______ 。
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能_______ 。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为_______ 。
②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_______ (填化学式),在350~400℃范围内,剩余固体的成分为_______ (填化学式)。

(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O
 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为

您最近一年使用:0次
2023-04-26更新
|
178次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
6 . 制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol•L-1硫酸铝酸性溶液,经检验,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5(温室下,0.1 mol•L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_______ 。
(2)往溶液中加入H2O2的作用是_______ (用离子方程式表示)。
(3)加入的X试剂(填选项编号)是_______ 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是_______ 。
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为
(2)往溶液中加入H2O2的作用是
(3)加入的X试剂(填选项编号)是
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
您最近一年使用:0次
名校
7 . Ⅰ.有下列物质:①Na2CO3•10H2O晶体;②铜;③硫酸溶液;④CO2;⑤NaHSO4固体;⑥Ba(OH)2固体;⑦红褐色的氢氧化铁胶体;⑧氨水;⑨稀硝酸;⑩Al2(SO4)3固体。
(1)上述物质属于电解质的有___________ (填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式___________ 。
(3)写出固体⑤溶于水中的电离方程式___________ 。
(4)17.1g⑩溶于水配成250mL溶液, 的物质的量浓度为
的物质的量浓度为___________ 。
Ⅱ.
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为___________ ,物质的量之比为___________ ,质量之比为___________ 。
(6)等质量的SO2和SO3物质的量之比是___________ ,氧原子数之比为___________ 。
(7)19g某二价金属的氯化物ACl2中含有0.4molCl-,则A的摩尔质量为___________ 。
(1)上述物质属于电解质的有
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式
(3)写出固体⑤溶于水中的电离方程式
(4)17.1g⑩溶于水配成250mL溶液,
 的物质的量浓度为
的物质的量浓度为Ⅱ.
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为
(6)等质量的SO2和SO3物质的量之比是
(7)19g某二价金属的氯化物ACl2中含有0.4molCl-,则A的摩尔质量为
您最近一年使用:0次
名校
8 . 酸与碱的中和反应在生活生产中有重要的应用。下图从不同角度反映稀硫酸和氢氧化钠溶液的反应。

请回答下列问题:
(1)图甲,烧杯中盛有氢氧化钠溶液,滴入2~3滴酚酞溶液,现象是_______ ,变色的原因是溶液的pH_______ 7(填写大于、等于或小于)。
(2)向稀硫酸中滴加氢氧化钠溶液,得到溶液pH与加入氢氧化钠溶液质量的关系如图乙。
①当加入ag氢氧化钠溶液时,此时溶液中的溶质是_______ (填写化学式)。
②当加入氢氧化钠溶液的质量正好反应到M点时,溶液中的主要离子及其比值是_______ (填写符号和比值)。
③当加入氢氧化钠溶液的质量为bg时,所得溶液中的pH_______ 7(填写大于、等于或小于)。
(3)在溶液中硫酸氢钠(NaHSO4)完全解离出Na+、H+、SO ,其溶液呈酸性。
,其溶液呈酸性。
①向硫酸氢钠溶液中滴加氢氧化钠溶液,完全反应的化学方程式是_______ 。
②向硫酸氢钠溶液中滴加氢氧化钡溶液反应至溶液呈中性,写出反应的化学方程式_______ 。

请回答下列问题:
(1)图甲,烧杯中盛有氢氧化钠溶液,滴入2~3滴酚酞溶液,现象是
(2)向稀硫酸中滴加氢氧化钠溶液,得到溶液pH与加入氢氧化钠溶液质量的关系如图乙。
①当加入ag氢氧化钠溶液时,此时溶液中的溶质是
②当加入氢氧化钠溶液的质量正好反应到M点时,溶液中的主要离子及其比值是
③当加入氢氧化钠溶液的质量为bg时,所得溶液中的pH
(3)在溶液中硫酸氢钠(NaHSO4)完全解离出Na+、H+、SO
 ,其溶液呈酸性。
,其溶液呈酸性。①向硫酸氢钠溶液中滴加氢氧化钠溶液,完全反应的化学方程式是
②向硫酸氢钠溶液中滴加氢氧化钡溶液反应至溶液呈中性,写出反应的化学方程式
您最近一年使用:0次
名校
9 . 我国科学家提出了由物质A和物质B转化为高附加值产品乙酸(CH3COOH)的催化反应历程,该历程示意图如下(模型中的短线仅代表原子间的连接方式)。
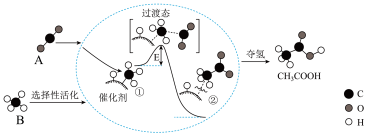
请回答下列问题:
(1)物质B的化学式是_______ ;实验室中制备A的化学方程式是_______ 。
(2)反应过程中,催化剂吸附的物质是_______ 。(写名称)
(3)写出物质A、B反应生成乙酸的化学方程式_______ 。
(4)物质A能与氢氧化钠溶液反应生成纯碱,反应的化学方程式是_______ 。
(5)物质B和乙酸都能完全燃烧生成二氧化碳和水,等质量的物质B和乙酸完全燃烧时消耗氧气的质量比为_______ 。

请回答下列问题:
(1)物质B的化学式是
(2)反应过程中,催化剂吸附的物质是
(3)写出物质A、B反应生成乙酸的化学方程式
(4)物质A能与氢氧化钠溶液反应生成纯碱,反应的化学方程式是
(5)物质B和乙酸都能完全燃烧生成二氧化碳和水,等质量的物质B和乙酸完全燃烧时消耗氧气的质量比为
您最近一年使用:0次
10 . 离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________ (填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、 、OH-、
、OH-、 和Cl-,取该溶液进行如下实验:
和Cl-,取该溶液进行如下实验:
Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许原溶液滴入BaCl2溶液,无白色沉淀产生。
Ⅲ.另取少许原溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。
Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是________ ;肯定存在的离子是________ 。
②写出实验Ⅲ中可能发生的反应的离子方程式:________ 。
③写出实验Ⅳ中产生白色沉淀的离子方程式:________ 。
④如溶液中各离子的个数相等,确定溶液中________ (填“有”或“无”)K+,判断依据是________ 。
(1)在发生离子反应的反应物或生成物中,一定存在
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、
 、OH-、
、OH-、 和Cl-,取该溶液进行如下实验:
和Cl-,取该溶液进行如下实验:Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许原溶液滴入BaCl2溶液,无白色沉淀产生。
Ⅲ.另取少许原溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。
Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是
②写出实验Ⅲ中可能发生的反应的离子方程式:
③写出实验Ⅳ中产生白色沉淀的离子方程式:
④如溶液中各离子的个数相等,确定溶液中
您最近一年使用:0次
2022-12-23更新
|
316次组卷
|
2卷引用:湖北省武汉市第六中学2020-2021学年高一上学期10月月考化学试题



