14-15高一上·甘肃天水·期中
名校
1 . 下列说法中正确的是
| A.某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B.能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D.H++OH-=H2O可描述所有酸碱中和反应的实质 |
您最近一年使用:0次
2016-12-09更新
|
1231次组卷
|
15卷引用:2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷
(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷湖北省沙市中学2017-2018学年高一上学期第四次双周考试化学试题【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高一上学期期中考试化学试题贵州省黄平县第二中学2018-2019学年高一上学期12月月考化学试题云南省元江县一中2020届高三上学期开学考试化学试题云南省河口县一中2019-2020学年高二上学期开学考试化学试题第2章《元素与物质世界》期中复习检测试卷云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题吉林省白城市第一中学2019-2020学年高一上学期期中考试化学试题湖南省长沙市长沙县第六中学2020届高三上学期第二次月考化学试题(已下线)第09练 离子反应-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高一上学期第一次月考化学试题
2 . 学兴趣小组同学在探究SO2与新制Cu(OH)2悬浊液反应,实验时发现了如下问题并展开实验探究,装置如图1:
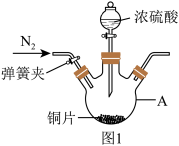
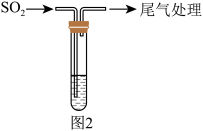
实验一:SO2的制备
(1)仪器A的名称是___ 。
(2)仪器A中加入浓硫酸加热产生的实验现象为___ 。实验前通入N2的目的是___ 。
实验二:探究SO2与新制Cu(OH)2悬浊液的反应
甲同学进行实验Ⅰ:在图2试管中滴加1.5mL1mol•L-1CuSO4溶液和3.5mL1mol•L-1NaOH溶液混合,开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,试管底部有少量紫红色固体,溶液呈蓝色。
乙同学进行实验Ⅱ:在试管中滴加1.5mL1mol•L-1CuCl2溶液和3.5mL1mol•L-1NaOH溶液混合,开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈蓝色。
(3)甲同学设计如下实验探究砖红色沉淀的主要成分。
取少量砖红色沉淀于试管中,加5mL蒸馏水,滴加少量稀硫酸,静置后观察到试管底部有少量紫红色固体,溶液呈蓝色,证明砖红色沉淀是___ (填“化学式”),发生的离子方程式为___ 。
(4)乙同学设计下列实验探究白色沉淀的主要成分。
向得到的19.9g白色沉淀中加入足量的稀硝酸,得到蓝色溶液;再向溶解后的溶液中加入足量的AgNO3溶液,过滤、洗涤、干燥,得到固体的质量为28.7g,则白色沉淀的化学式为___ ,加入足量的稀硝酸反应的离子方程式为___ 。
(5)丙同学针对实验和Ⅱ中出现的实验现象,重新用实验Ⅱ的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净,再向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,得到的现象与实验Ⅰ相同,说明实验Ⅰ和Ⅱ现象不同的原因是___ 。


实验一:SO2的制备
(1)仪器A的名称是
(2)仪器A中加入浓硫酸加热产生的实验现象为
实验二:探究SO2与新制Cu(OH)2悬浊液的反应
甲同学进行实验Ⅰ:在图2试管中滴加1.5mL1mol•L-1CuSO4溶液和3.5mL1mol•L-1NaOH溶液混合,开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,试管底部有少量紫红色固体,溶液呈蓝色。
乙同学进行实验Ⅱ:在试管中滴加1.5mL1mol•L-1CuCl2溶液和3.5mL1mol•L-1NaOH溶液混合,开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈蓝色。
(3)甲同学设计如下实验探究砖红色沉淀的主要成分。
取少量砖红色沉淀于试管中,加5mL蒸馏水,滴加少量稀硫酸,静置后观察到试管底部有少量紫红色固体,溶液呈蓝色,证明砖红色沉淀是
(4)乙同学设计下列实验探究白色沉淀的主要成分。
向得到的19.9g白色沉淀中加入足量的稀硝酸,得到蓝色溶液;再向溶解后的溶液中加入足量的AgNO3溶液,过滤、洗涤、干燥,得到固体的质量为28.7g,则白色沉淀的化学式为
(5)丙同学针对实验和Ⅱ中出现的实验现象,重新用实验Ⅱ的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净,再向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,得到的现象与实验Ⅰ相同,说明实验Ⅰ和Ⅱ现象不同的原因是
您最近一年使用:0次
名校
解题方法
3 . 能正确表示下列反应的离子方程式是( )
| A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
B.0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:Al3++2 +2Ba2++4OH-=2BaSO4↓+ +2Ba2++4OH-=2BaSO4↓+ +2H2O +2H2O |
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: 2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
| D.向FeI2溶液中通入一定量的氯气:2Fe2++ 2I- +2Cl2 =2Fe3++ I2 + 4Cl- |
您最近一年使用:0次
2020-10-12更新
|
106次组卷
|
2卷引用:甘肃省武威第一中学2021届高三上学期第三次阶段性考试化学试题
名校
4 . (1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为________ 。
(2)硫酸铝溶液与过量氨水反应的离子方程式为_______________________________ 。
(3)能证明Na2SO3溶液中存在SO32-+H2O⇌HSO3-+OH-水解平衡的事实是________ (填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用______________ 式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是_____________ 且30s不变色。
(2)硫酸铝溶液与过量氨水反应的离子方程式为
(3)能证明Na2SO3溶液中存在SO32-+H2O⇌HSO3-+OH-水解平衡的事实是
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用
您最近一年使用:0次
名校
5 . 氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.已知:氯化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:______________________ 。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是______________________ 。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH Na2S2O8+2NH3↑十2H2O
Na2S2O8+2NH3↑十2H2O
副反应:2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
某化学兴趣小组利用上述原理在实验室制备过硫酸钠并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是______________________ 。
(4)装置a中反应产生的气体需要持续通入装置c的原因是______________________ 。
(5)上述装置中还需补充的实验仪器或装置有___________ (填字母)。
A温度计 B洗气瓶 C.水浴装置 D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg·L-1。
②Ag++2CN-===[Ag(CN)2]-,Ag++I-===AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定终点的现象是____________________________________________ 。
(7)处理后的废水中氰化钠的浓度为___________ mg·L-1;处理后的废水是否达到排放标准?___________ (填“是”或“否”)。
I.已知:氯化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH
 Na2S2O8+2NH3↑十2H2O
Na2S2O8+2NH3↑十2H2O副反应:2NH3+3Na2S2O8+6NaOH
 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2某化学兴趣小组利用上述原理在实验室制备过硫酸钠并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是
(4)装置a中反应产生的气体需要持续通入装置c的原因是
(5)上述装置中还需补充的实验仪器或装置有
A温度计 B洗气瓶 C.水浴装置 D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg·L-1。
②Ag++2CN-===[Ag(CN)2]-,Ag++I-===AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定终点的现象是
(7)处理后的废水中氰化钠的浓度为
您最近一年使用:0次
2019-01-15更新
|
434次组卷
|
2卷引用:甘肃省张掖市第二中学2020届高三上学期11月月考化学试题
名校
6 . 下列化学过程及其表述正确的是( )
| A.向NaHSO4溶液中滴入Ba (OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4 ↓+H2O |
| B.由水电离的c (H+) 为10-13mol·L-l 的溶液中;Na+、NO3-、SO32-、Cl-一定能大量共存 |
| C.可以用硫氰化钾溶液来检验FeCl2溶液中的溶质是否被氧化 |
| D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,证明H2O2 具有还原性 |
您最近一年使用:0次
2018-02-06更新
|
262次组卷
|
6卷引用:【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题
11-12高二上·甘肃张掖·期中
7 . 证明某白色晶体是(NH4)2SO4的简单实验操作如下:取少量白色晶体于一小烧杯中,加入适量蒸馏水制成溶液。
(1)证明溶液中含SO42-,主要的实验操作及现象为:____________________________ ;发生反应的离子方程式是:__________________________ ;
(2)证明溶液中含有NH4+,主要实验操作及现象为_______________________ ;发生反应的离子方程式是:____________________________________ 。
(1)证明溶液中含SO42-,主要的实验操作及现象为:
(2)证明溶液中含有NH4+,主要实验操作及现象为
您最近一年使用:0次
11-12高三上·甘肃兰州·期中
解题方法
8 . 某强酸性溶液X中含有Ba2+、A l3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
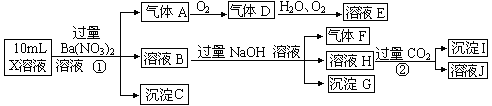
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是____________________ ,不能确定的阳离子是___________ ,若要用实验证明该离子一定不存在,其最可靠的化学方法是________________________ 。
(2)沉淀G的化学式为_____________ 。
(3)写出下列反应的离子方程式:
①中生成气体A:__________________ 。
②生成沉淀I:__________________________ 。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________ ,沉淀C物质的量___________ 。

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是
(2)沉淀G的化学式为
(3)写出下列反应的离子方程式:
①中生成气体A:
②生成沉淀I:
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是
您最近一年使用:0次
名校
解题方法
9 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如下图所示(
的混合溶液中回收S,其转化如下图所示( 不溶于水)。下列说法中,不正确的是
不溶于水)。下列说法中,不正确的是
 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如下图所示(
的混合溶液中回收S,其转化如下图所示( 不溶于水)。下列说法中,不正确的是
不溶于水)。下列说法中,不正确的是
A.回收S的总反应为: |
B.过程①中,生成 的反应为: 的反应为: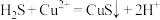 |
C.过程②中, 作氧化剂 作氧化剂 |
| D.过程③中,各元素化合价均未改变 |
您最近一年使用:0次
2023-04-22更新
|
1452次组卷
|
52卷引用:北京市2020年普通高中学业水平合格性模拟考试化学试题
北京市2020年普通高中学业水平合格性模拟考试化学试题北京市首都师范大学附属中学2019-2020学年高一下学期期末考试化学(非选考)试题2020年北京市第一次普通高中学业水平合格性考试化学试题北京市海淀区19中2019-2020学年高一下学期期末考试化学试题江苏省靖江高级中学2020-2021学年度高一上学期第一次阶段考试化学试题广东省河源高级中学2020-2021学年高一上学期第一次段考化学试题江苏省宜兴市第一中学2020-2021学年高一上学期第一次阶段性检测化学试题江苏省南京市金陵中学河西分校2020-2021学年高一上学期10月月考化学试题甘肃省兰州大学附属中学2022-2023学年高一下学期5月月考(分班考试)化学试题北京市石景山区2020-2021学年高一上学期期末调研化学试卷题北京市第三十五中学2020-2021学年 高一下学期期中测试化学试题北京市第一五九中学2020-2021学年高一下学期期中考化学试题北京市第五十六中学2020-2021学年高一下学期期中考试化学试题北京市第五中学2020-2021学年高一下学期第一次阶段考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高一上学期10月月考化学试题广东省东莞市光明中学2021-2022学年高一上学期第一次月考化学试题(已下线)4.2.1 含硫物质间的转化-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)河北正中实验中学2021-2022学年高一上学期期中考试化学试题山西省太原市第五中学2021-2022学年高一上学期12月月考化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题安徽省六安市第一中学2021-2022学年高一下学期开学考试化学试题江苏省泰州中学2021-2022学年高一上学期期末考试化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题(已下线)第13讲 铁的氧化物和铁的氢氧化物-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)北京市石景山区2021-2022学年高一下学期期末考试化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高一上学期10月月考化学试题黑龙江省大庆铁人中学2022-2023学年高一上学期第一次月考化学试题北京市首师附密云中学2021-2022学年高一下学期等级考化学试题(已下线)易错点04 氧化还原反应-备战2023年高考化学考试易错题北京市第六十六中学2022-2023学年高一上学期期中考试化学试题北京市第十二中学2022-2023学年高一上学期期中考试化学试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题湖北省武汉大学附属中学2021-2022学年高二上学期开学考试化学试题北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷北京师范大学附属中学2022-2023学年高一上学期期末考试化学试题四川省成都市第七中学2022-2023学年高一上学期期末考试化学试题江西省南昌市2022-2023学年高一下学期选课走班调研检测化学试题江苏省淮安市2022-2023学年高一上学期期末考试化学试题第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)北京市西城外国语学校2022-2023学年高一下学期期中考试化学试题(已下线)北京市第四中学2022~2023学年高一下学期期中考试化学试题陕西省西安市第八十五中学2022-2023学年高一下学期月考化学试题 江苏省南京市江宁区2022-2023学年高一下学期期末考试化学试题广东省部分名校2023-2024学年高一上学期期中联合考试化学试题广东省珠海市第二中学2023-2024学年高一上学期10月月考化学试题广东省茂名市化州市第一中学2023-2024学年高一上学期期中测评化学试题(已下线)专题07 硫及含硫化合物 环境保护-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省泗阳县实验高级中学2023-2024学年高一上学期第二次调研测试化学试卷江苏省泰州市2023-2024学年高一上学期1月期末化学试题宁夏石嘴山第三中学2023-2024学年高三上学期期中考试化学试题(已下线)安徽省皖北县中联盟2023-2024学年高一下学期3月月考化学试题
名校
解题方法
10 . 将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示。下列说法错误的是
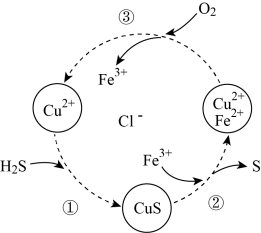
| A.过程①发生非氧化还原反应 |
| B.过程②中,发生反应为S2-+2Fe3+=S↓+2Fe2+ |
| C.过程③中,氧气是氧化剂 |
| D.整个转化过程中Fe3+可以循环使用 |
您最近一年使用:0次
2023-02-22更新
|
356次组卷
|
14卷引用:湖南省怀化市2019-2020学年高一下学期期末考试化学试题
湖南省怀化市2019-2020学年高一下学期期末考试化学试题江西省南昌市第二中学2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】2. 南昌二中 左佳鑫广东省中山纪念中学2020-2021学年高一上学期第一次段考化学试题江西省靖安中学2021届高三上学期第四次月考化学试题甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题河南省名校联盟2021-2022学年高三上学期第三次诊断考试化学试题辽宁省沈阳市第十中学2021-2022学年高一下学期4月月考化学试题广东实验中学附属天河学校2021-2022学年高一上学期期中考试化学试题上海交通大学附属中学2022-2023学年高一分科考试化学试题广东省广州市西关外国语中学2022-2023学年高一上学期期中考试化学试题(已下线)专题03 氧化还原反应【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)广东省广州市第十七中学2023-2024学年高一上学期11月期中考试化学试题山东省济宁市育才中学2023-2024学年高一下学期4月月考化学试题



