名校
1 . 铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式_____________________________ 。
(2)为了保护环境和节约资源,通常先用 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式__________________________ 。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应: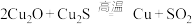 ,该反应的氧化剂是
,该反应的氧化剂是________ ;当生成 时,反应中转移的电子为
时,反应中转移的电子为______  。
。
(4)研究性学习小组用“间接碘量法”测定某试样中 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式__________________________ 。
(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为: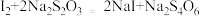 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为______________________ 。
(1)写出铜与稀硝酸反应的化学方程式
(2)为了保护环境和节约资源,通常先用
 和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
和稀硫酸的混合溶液溶出废旧卬刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:
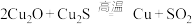 ,该反应的氧化剂是
,该反应的氧化剂是 时,反应中转移的电子为
时,反应中转移的电子为 。
。(4)研究性学习小组用“间接碘量法”测定某试样中
 (不含能与I-反应的氧化性杂质)的含量,取
(不含能与I-反应的氧化性杂质)的含量,取 试样配成
试样配成 溶液,每次取
溶液,每次取 ,滴加
,滴加 溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
溶液后有白色碘化物沉淀生成,写出该反应的离子方程式(5)继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫化硫酸钠标准溶液滴定,发生反应的化学方程式为:
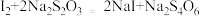 ,平均消耗
,平均消耗 的
的 溶液
溶液 。则试样中
。则试样中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-04-29更新
|
123次组卷
|
2卷引用:甘肃省天水市甘谷县第四中学2021届高三上学期第二次检测化学试题
真题
2 . 息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1) 第①步Cu与酸反应的离子方程为______ ;得到滤渣1的主要成分为______ 。
(2) 第②步加H2O2的作用是______ ,使用H2O2的优点是______ ;调溶液pH的目的是使______ 生成沉淀。
(3) 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______ 。
(4) 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,______ 方案不可行,原因是______ ;从原子利用率角度考虑,______ 方案更合理。
(5) 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=______ ;
②下列操作会导致CuSO4·5H2O含量的测定结果偏高的是______ 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子

请回答下列问题:
(1) 第①步Cu与酸反应的离子方程为
(2) 第②步加H2O2的作用是
(3) 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是
(4) 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,
(5) 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=
②下列操作会导致CuSO4·5H2O含量的测定结果偏高的是
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
您最近一年使用:0次
3 . 肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。CO(NH2) + 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是____________ ;
实验二:制取水合肼(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是___________ (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是_________________________________ ;
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式_______________________ ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________________ 。
(4)滴定时,碘的标准溶液盛放在____________ 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_____ (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是:________________ 。
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是
实验二:制取水合肼(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式
(4)滴定时,碘的标准溶液盛放在
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是:
您最近一年使用:0次
2016-12-09更新
|
107次组卷
|
3卷引用:2015届甘肃省张掖市高三4月诊断考试理综化学试卷
4 . CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是____________________ 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________ ;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________ 。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________ 、________________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为________________ 。
(5)萃取剂的作用是__________________ 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________ 。

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是
(2)写出NaClO3在浸出液中发生主要反应的离子方程式
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式
(3) “操作1”中包含3个基本实验操作,它们依次是
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为
(5)萃取剂的作用是
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是
您最近一年使用:0次
名校
5 . Ⅰ.过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式_______________
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是______________
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%∼70%的过氧化氢溶液中,则该反应的化学方程式_______
Ⅱ. 某厂废水中含KCN,其浓度为650mg⋅L−1现用氯氧化法处理,发生如下反应(其中N均为−3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是____________________ .
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
___ KOCN+___ KOH+___ Cl2→_____ CO2+_____ N2+_____ KCl+______ H2O
(3)若将10m3含KCN的浓度为650mg⋅L−1的废水中KCN氧化除去,需要标准状况下的氯气的体积为______________________ L.
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%∼70%的过氧化氢溶液中,则该反应的化学方程式
Ⅱ. 某厂废水中含KCN,其浓度为650mg⋅L−1现用氯氧化法处理,发生如下反应(其中N均为−3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
(3)若将10m3含KCN的浓度为650mg⋅L−1的废水中KCN氧化除去,需要标准状况下的氯气的体积为
您最近一年使用:0次
名校
6 . 根据信息写方程式:
(1)Pb与C同主族,化合价有+2价和+4价,PbO与PbO2是铅的两种常见氧化物,已知PbO2具有强氧化性,与浓盐酸共热可生成一种黄绿色气体和PbCl2 。试写出Pb3O4与浓盐酸反应的化学方程式:__________________________________ 。
(2)过氧化钠可用于实验室制O2,其化学方程式为__________________________________ 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为______________________________ 。
(4)Fe的一种含氧酸根FeO42-- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是__________________________________ 。
(5)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。写出加入H2O2氧化时发生反应的化学方程式:______________________________________ 。
(1)Pb与C同主族,化合价有+2价和+4价,PbO与PbO2是铅的两种常见氧化物,已知PbO2具有强氧化性,与浓盐酸共热可生成一种黄绿色气体和PbCl2 。试写出Pb3O4与浓盐酸反应的化学方程式:
(2)过氧化钠可用于实验室制O2,其化学方程式为
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
(4)Fe的一种含氧酸根FeO42-- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
(5)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。写出加入H2O2氧化时发生反应的化学方程式:
您最近一年使用:0次
2018-09-27更新
|
394次组卷
|
3卷引用:甘肃省白银市会宁二中2019届高三上学期9月月考化学试题
7 . 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①_______________________________________ (写出离子方程式);
②3Br2+3CO32—=BrO3—+5Br-+3CO2↑;
③_______________________________________ (写出离子方程式);
(2)空气吹出SO2吸收法。该方法基本同(1),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式____________ 。
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。下图为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线。写出100℃时所发生的反应的化学方程式______ ;工业上富集HDO的生产过程中,可以循环利用的一种物质是____ 。

(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①
②3Br2+3CO32—=BrO3—+5Br-+3CO2↑;
③
(2)空气吹出SO2吸收法。该方法基本同(1),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。下图为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线。写出100℃时所发生的反应的化学方程式

您最近一年使用:0次
10-11高三上·福建南平·阶段练习
名校
解题方法
8 . 北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式_______(将化学计量数填于空白处)
_______ KIO3+_______ KI+_______ H2SO4=_______ K2SO4+_______ I2+_______ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式_______ 。
(3)已知:I2+2S2O =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______ 。
②b中反应所产生的I2的物质的量是_______ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_______ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式
(3)已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
您最近一年使用:0次
名校
9 . 氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.已知:氯化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:______________________ 。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是______________________ 。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH Na2S2O8+2NH3↑十2H2O
Na2S2O8+2NH3↑十2H2O
副反应:2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
某化学兴趣小组利用上述原理在实验室制备过硫酸钠并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是______________________ 。
(4)装置a中反应产生的气体需要持续通入装置c的原因是______________________ 。
(5)上述装置中还需补充的实验仪器或装置有___________ (填字母)。
A温度计 B洗气瓶 C.水浴装置 D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg·L-1。
②Ag++2CN-===[Ag(CN)2]-,Ag++I-===AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定终点的现象是____________________________________________ 。
(7)处理后的废水中氰化钠的浓度为___________ mg·L-1;处理后的废水是否达到排放标准?___________ (填“是”或“否”)。
I.已知:氯化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH
 Na2S2O8+2NH3↑十2H2O
Na2S2O8+2NH3↑十2H2O副反应:2NH3+3Na2S2O8+6NaOH
 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2某化学兴趣小组利用上述原理在实验室制备过硫酸钠并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
【实验一】实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是
(4)装置a中反应产生的气体需要持续通入装置c的原因是
(5)上述装置中还需补充的实验仪器或装置有
A温度计 B洗气瓶 C.水浴装置 D.酒精灯
【实验二】测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg·L-1。
②Ag++2CN-===[Ag(CN)2]-,Ag++I-===AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定终点的现象是
(7)处理后的废水中氰化钠的浓度为
您最近一年使用:0次
2019-01-15更新
|
434次组卷
|
2卷引用:甘肃省张掖市第二中学2020届高三上学期11月月考化学试题
10 . 【化学—选修2:化学与技术】
(1)天然水中含有细菌,其主要成分是蛋白质,写出两种家庭中能杀灭水中细菌的简单方法____________________、____________________。
(2)现有一杯具有永久硬度的水,其中主要含有MgCl2、CaCl2。利用下列试剂中的一部分或全部,设计软化该水的实验方案。
试剂:①Ca(OH)2溶液 ②NaOH溶液 ③饱和Na2CO3溶液 ④肥皂水
实验方案:(填写下表)
(3)利用海水得到淡水的方法有蒸馏法、电渗析法等。电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
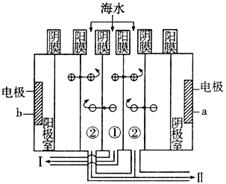
a接电源的__________极,I口排出的是__________(填“淡水”或“海水”)。
(4)在(3)中某口排出的浓海水中溴元素的质量分数为a%,现用氯气将其中的溴离子氧化为溴单质,则处理1000 t该浓海水需标准状况下的氯气的体积为__________m3。
(1)天然水中含有细菌,其主要成分是蛋白质,写出两种家庭中能杀灭水中细菌的简单方法____________________、____________________。
(2)现有一杯具有永久硬度的水,其中主要含有MgCl2、CaCl2。利用下列试剂中的一部分或全部,设计软化该水的实验方案。
试剂:①Ca(OH)2溶液 ②NaOH溶液 ③饱和Na2CO3溶液 ④肥皂水
实验方案:(填写下表)
| 实验步骤 | 现象 | 离子方程式 |
| ①向硬水中加入Ca(OH)2溶液,直到__________为止。 | ||
| ②继续向溶液中加入__________溶液,直到不再产生沉淀为止。 | ||
| ③将上述混合物__________(填操作名称)。 | —— | —— |
(3)利用海水得到淡水的方法有蒸馏法、电渗析法等。电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。

a接电源的__________极,I口排出的是__________(填“淡水”或“海水”)。
(4)在(3)中某口排出的浓海水中溴元素的质量分数为a%,现用氯气将其中的溴离子氧化为溴单质,则处理1000 t该浓海水需标准状况下的氯气的体积为__________m3。
您最近一年使用:0次
2016-12-09更新
|
171次组卷
|
2卷引用:2015届甘肃省天水市秦安县高三第一次模拟考试化学试卷



