解题方法
1 . I.水中溶解氧气的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,反应方程式为2S2O +I2=S4O
+I2=S4O +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 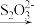 S4O
S4O 。
。
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________ 。
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为_________ mg·L-1。
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为________ mol/L(保留一位小数),需用量筒量取30%的双氧水_________ mL。
(2)该实验在酸性条件下进行,则实验设计的反应原理是_____________ (用离子方程式表示)。
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为_________ (用含a、b的式子表示)。
 +I2=S4O
+I2=S4O +2I-,测定过程中物质的转化关系如下:O2
+2I-,测定过程中物质的转化关系如下:O2 2MnO(OH)2
2MnO(OH)2 I2
I2 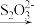 S4O
S4O 。
。(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
(2)取池塘水样100.00 mL,按上述方法测定水中溶解的氧气浓度,消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中溶解的氧气浓度为
Ⅱ.益源生(药品名叫复方硫酸亚铁叶酸片)是一种治疗缺铁性贫血的药物其主要成分有硫酸亚铁、叶酸、干酵母、当归、黄芪、白术等,下面是测定益源生中硫酸亚铁质量分数的实验。取10片复方硫酸亚铁片(每片a毫克)研成粉末,加水溶解,过滤,再将滤液配成100 mL溶液,取出25 mL与双氧水反应(假设叶酸、干酵母、当归、黄芪、白术均不与双氧水反应)。
(1)配制一定浓度的双氧水溶液用质量分数30%、密度1.l g/cm3)的双氧水配制1.0 mol/L的双氧水100 mL,则30%双氧水物质的量浓度为
(2)该实验在酸性条件下进行,则实验设计的反应原理是
(3)若上述实验消耗1.0 mol/L的双氧水b mL,则每片复方硫酸亚铁叶酸片中硫酸亚铁的质量分数为
您最近一年使用:0次
2 . 已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓) CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于___________ (用字母代号填写)
A.酸 B.非电解质 C.盐 D. 酸性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是___________ ,
(3)一定量的铜片与200mL18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为___________ mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是___________
 CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:(1)A物质可以导致酸雨的形成。则A应该属于
A.酸 B.非电解质 C.盐 D. 酸性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是
(3)一定量的铜片与200mL18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是
您最近一年使用:0次
2020-12-19更新
|
157次组卷
|
2卷引用:江西省余干县新时代学校2020-2021学年高一上学期阶段测试(二)化学试题
名校
3 . (1)将铝片投入氢氧化钠溶液的离子反应方程式为:_____ 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2L 等浓度的Ba(OH)2溶液,离子反应方程式为:__ 。
(3)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为___ 。
(4)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为____ 。
(5)Fe的一种含氧酸根 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是______ 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2L 等浓度的Ba(OH)2溶液,离子反应方程式为:
(3)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为
(4)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
(5)Fe的一种含氧酸根
 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是
您最近一年使用:0次
2020-10-30更新
|
244次组卷
|
2卷引用:辽宁省实验中学东戴河校区2021届高三上学期第一次月考化学试题
名校
解题方法
4 . Li-CuO二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。
(1)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。比较Li、Na、Al分别作为电极时比能量由大到小的顺序为:__________________ 。
(2)通过如下过程制备CuO。

①过程I,H2O2的作用是________________________ 。
②过程II产生Cu2(OH)2CO3的离子方程式是_______________________ 。
③过程II,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%。

二者比值为1:0.8时,产品中可能含有的杂质是________________________ 。
(3)Li-CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理为:2Li+CuO=Li2O+Cu装置示意图如下。放电时,正极的电极反应式是______________________ 。

(1)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。比较Li、Na、Al分别作为电极时比能量由大到小的顺序为:
(2)通过如下过程制备CuO。

①过程I,H2O2的作用是
②过程II产生Cu2(OH)2CO3的离子方程式是
③过程II,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%。

二者比值为1:0.8时,产品中可能含有的杂质是
(3)Li-CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理为:2Li+CuO=Li2O+Cu装置示意图如下。放电时,正极的电极反应式是

您最近一年使用:0次
名校
解题方法
5 . 某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________ 。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________ 。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________ (用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- R4V4O12+4OH-(ROH 为强碱性阴离子交换树脂)。“流出液”中阳离子最多的是
R4V4O12+4OH-(ROH 为强碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________ ;为了提高洗脱效率,淋洗液应该呈______ 性(填“酸”、“碱“或“中”)。
(5) “沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________ 。
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124-
 R4V4O12+4OH-(ROH 为强碱性阴离子交换树脂)。“流出液”中阳离子最多的是
R4V4O12+4OH-(ROH 为强碱性阴离子交换树脂)。“流出液”中阳离子最多的是(5) “沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式
您最近一年使用:0次
2018-01-18更新
|
372次组卷
|
2卷引用:辽宁省瓦房店市2018届高三下学期第一次模拟理综化学试题
6 . 工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:

请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为_______ 。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:_______________________________ 。
(3)向Ce(BF4)3中加入KCl溶液的目的是__________________ 。
(4)溶液中的C(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,此时溶液的PH为__________ 。(已知KSP[Ce(OH)3]=1×10-20)
(5)加热CeCl3.6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是______________ 。
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0.1000mol.l-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00ml标准溶液。(已知:Fe2++Ce4+=
Ce3++Fe3+)
①该样品中CeCl3的质量分数为____________ 。
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数________ (填“偏大”、“偏小”或“无影响”)

请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:
(3)向Ce(BF4)3中加入KCl溶液的目的是
(4)溶液中的C(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,此时溶液的PH为
(5)加热CeCl3.6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0.1000mol.l-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00ml标准溶液。(已知:Fe2++Ce4+=
Ce3++Fe3+)
①该样品中CeCl3的质量分数为
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数
您最近一年使用:0次
2016-12-09更新
|
490次组卷
|
4卷引用:【全国市级联考】辽宁省凌源市2017-2018学年高二下学期期中考试化学试题
7 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
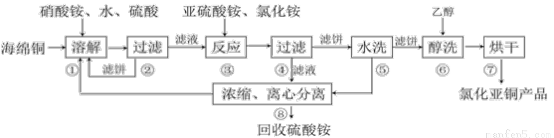
回答下列问题:
(1)步骤①溶解温度应控制在60~70度,原因是_____________ ,加入硝酸铵的作用是_____________ 。
(2)写出步骤③中主要反应的离子方程式_______________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________ 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①溶解温度应控制在60~70度,原因是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
8 . 【化学—选修2:化学与技术】
(1)天然水中含有细菌,其主要成分是蛋白质,写出两种家庭中能杀灭水中细菌的简单方法____________________、____________________。
(2)现有一杯具有永久硬度的水,其中主要含有MgCl2、CaCl2。利用下列试剂中的一部分或全部,设计软化该水的实验方案。
试剂:①Ca(OH)2溶液 ②NaOH溶液 ③饱和Na2CO3溶液 ④肥皂水
实验方案:(填写下表)
(3)利用海水得到淡水的方法有蒸馏法、电渗析法等。电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
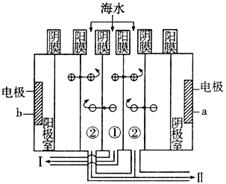
a接电源的__________极,I口排出的是__________(填“淡水”或“海水”)。
(4)在(3)中某口排出的浓海水中溴元素的质量分数为a%,现用氯气将其中的溴离子氧化为溴单质,则处理1000 t该浓海水需标准状况下的氯气的体积为__________m3。
(1)天然水中含有细菌,其主要成分是蛋白质,写出两种家庭中能杀灭水中细菌的简单方法____________________、____________________。
(2)现有一杯具有永久硬度的水,其中主要含有MgCl2、CaCl2。利用下列试剂中的一部分或全部,设计软化该水的实验方案。
试剂:①Ca(OH)2溶液 ②NaOH溶液 ③饱和Na2CO3溶液 ④肥皂水
实验方案:(填写下表)
| 实验步骤 | 现象 | 离子方程式 |
| ①向硬水中加入Ca(OH)2溶液,直到__________为止。 | ||
| ②继续向溶液中加入__________溶液,直到不再产生沉淀为止。 | ||
| ③将上述混合物__________(填操作名称)。 | —— | —— |
(3)利用海水得到淡水的方法有蒸馏法、电渗析法等。电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。

a接电源的__________极,I口排出的是__________(填“淡水”或“海水”)。
(4)在(3)中某口排出的浓海水中溴元素的质量分数为a%,现用氯气将其中的溴离子氧化为溴单质,则处理1000 t该浓海水需标准状况下的氯气的体积为__________m3。
您最近一年使用:0次
2016-12-09更新
|
171次组卷
|
2卷引用:2015届哈师附中、东北师附、辽宁实验高三一模联考化学试卷
解题方法
9 . 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
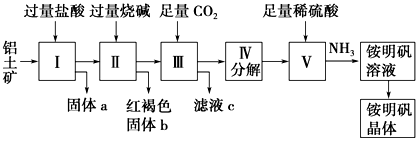
请回答下列问题:
(1)固体a的化学式为_______________ ,Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________ 。
(2)由Ⅴ制取铵明矾溶液的化学方程式为____________ ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)______________ 、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g/cm3)_________________ L(保留4位有效数字)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为____________________ 。

请回答下列问题:
(1)固体a的化学式为
(2)由Ⅴ制取铵明矾溶液的化学方程式为
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g/cm3)
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为
您最近一年使用:0次
10 . 大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“三苏”,它们在生活、生产中用途广泛。
(1)工业上,将苏打和硫化钠以1:2的物质的量之比配成溶液,再通入SO2气体,可制得Na2S2O3,同时放出CO2。写出该反应的化学方程式____________ 。硫化钠溶液在空气中久置,会生成淡黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式_______________ 。
(2)Na2S2O3标准液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因______________ 。
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,写出离子方程式____________________ 。
(4)工业上常用苏打和盐酸除去锅炉中水垢中的硫酸钙。先用饱和苏打溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是____________ 。(并用离子方程式表示)
(5)在密闭的容器中投入一定量的Na2O2和NaHCO3固体,在300℃下充分反应。若残留固体为纯净物,则起始时n(NaHCO3):n(Na2O2)满足的条件是________________ 。
(1)工业上,将苏打和硫化钠以1:2的物质的量之比配成溶液,再通入SO2气体,可制得Na2S2O3,同时放出CO2。写出该反应的化学方程式
(2)Na2S2O3标准液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,写出离子方程式
(4)工业上常用苏打和盐酸除去锅炉中水垢中的硫酸钙。先用饱和苏打溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是
(5)在密闭的容器中投入一定量的Na2O2和NaHCO3固体,在300℃下充分反应。若残留固体为纯净物,则起始时n(NaHCO3):n(Na2O2)满足的条件是
您最近一年使用:0次



