名校
解题方法
1 . 由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有_______ 。
(2)在进行滴定操作时,KMnO4溶液盛装在_______ (填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,_______ 时达到滴定终点。
(3)滴定过程中发生反应的离子方程式是_______ ;测得该样品中NaNO2的质量分数为_______ 。
(4)以下操作造成测定结果偏高的是_______。
(5)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =
=_______ 。(结果保留两位有效数字)(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
(6)已知: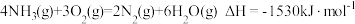 ,
,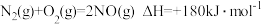 ,写出
,写出 还原
还原 的热化学方程式:
的热化学方程式:_______ 。
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有
(2)在进行滴定操作时,KMnO4溶液盛装在
(3)滴定过程中发生反应的离子方程式是
(4)以下操作造成测定结果偏高的是_______。
| A.滴定管未用KMnO4标准溶液润洗 |
| B.锥形瓶未用待测液润洗 |
| C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失 |
| D.若滴定过程中刚出现颜色变化就停止滴定 |
 =
=(6)已知:
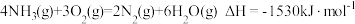 ,
,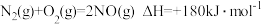 ,写出
,写出 还原
还原 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
2 . 乳酸亚铁{[CH3CH(OH)COO]2Fe·3H2O,Mr=288}是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O → [CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2 = 4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:

回答下列问题:
(1)NH4HCO3盛放在装置______________ 中(填字母),该装置中涉及的主要反应的离子方程式为____________________________________________________________________ 。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是__________________________ 。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是__________________________________ 。反应结束后,无需过滤,除去过量铁粉的方法是________________________________ 。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是_____________________________________ 。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL进行必要处理,用0.100 0 mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70 mL。滴定反应如下:Ce4++Fe2+ = Ce3++Fe3+,则产品中乳酸亚铁的质量分数为________ 。
已知FeCO3易被氧化:4FeCO3+6H2O+O2 = 4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:

回答下列问题:
(1)NH4HCO3盛放在装置
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
974次组卷
|
3卷引用:2015届四川省绵阳市高三5月模拟练习卷化学试卷
3 . 某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________ ,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及________________________________
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是_____________________ ,反应的化学方程式是________________________ ,_____________________
(5)该样品中铝的质量分数是:_______________________________ (用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:
(2)步骤③中生成沉淀的离子方程式为:
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是
(5)该样品中铝的质量分数是:
(6)下列因操作不当,会使测定结果偏大的是
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
您最近一年使用:0次
名校
解题方法
4 . 某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是_____ ,操作②的名称是_____ 。
(2)试剂a是____ (填化学式,下同),固体B是____ 。
(3)加入试剂a所发生反应的化学方程式为____ 。加入试剂b所发生反应的离子方程式为________ 。
(4)该方案能否达到实验目的:_______ (填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)______ 。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是_____ 的质量。

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是
(2)试剂a是
(3)加入试剂a所发生反应的化学方程式为
(4)该方案能否达到实验目的:
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是
您最近一年使用:0次
名校
解题方法
5 . 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示,提示:SiO2不与HCl反应。

请回答下列问题:
(1)固体a的化学式为___ 。
(2)由图中Ⅱ所发生的离子方程式为___ 、___ 、___ 。Ⅲ所发生的离子方程式为___ 。
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__ 、冷却结晶、过滤洗涤。
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)__ L(保留一位小数)。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为___ 。

请回答下列问题:
(1)固体a的化学式为
(2)由图中Ⅱ所发生的离子方程式为
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为
您最近一年使用:0次
6 . 过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:

回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___ 。
(2)仪器X的主要作用除导气外,还具有的作用是___ 。
(3)在冰水浴中进行的原因是___ 。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___ 。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____ 。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___ 。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____ 的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____ 。

回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有
(2)仪器X的主要作用除导气外,还具有的作用是
(3)在冰水浴中进行的原因是
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为
您最近一年使用:0次
2019-11-21更新
|
300次组卷
|
3卷引用:【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题
【市级联考】四川省攀枝花市2019—2020学年高三上学期第一次统考化学试题2020届高三《新题速递·化学》12月第01期(考点12-15)(已下线)考点21 物质制备型综合实验-2020年高考化学命题预测与模拟试题分类精编
名校
7 . 碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下,(已知TeO2微溶于水,易溶于强酸和强碱),下列有关说法不正确的是


| A.将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率 |
| B.“碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O |
| C.“沉碲”时为使碲元素沉淀充分,应加入过量的硫酸 |
| D.若提取过程碲元素的回收率为90%,则处理1kg这种阳极泥最少需通入标准状况下SO2 20.16L |
您最近一年使用:0次
2019-02-05更新
|
414次组卷
|
8卷引用:浙江省“七彩阳光”联盟2018届高三上学期期中考试化学试题
浙江省“七彩阳光”联盟2018届高三上学期期中考试化学试题浙江省诸暨中学2017-2018学年高三上学期第二阶段考化学试题【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题浙江省杭州学军中学2021届高三上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高三上】【期中】【HD-LP423】【化学】(已下线)【浙江新东方】120四川省内江市第六中学2021-2022学年高一下学期期中考试化学试题第四章 非金属及其化合物 第25讲 非金属及其化合物知识落实与拓展
8 . 我国是世界铅生产和铅消费大国,铅被作为工业原料广泛应用于工业生产中,会以废气、废水、废渣比等各种形式排放于环境中,造成大面积污染,如何有效解决铅污染问题是我国当前面临的重要任务。
I.以方铅矿(PbS)为原料制备铅的相关化合物的工艺流程如图所示:

(1)“焙烧”时,提高反应速率的措施有_______ (写一条)。
(2)写出“高温还原”的主要化学方程式_______ 。
(3)“粗铅”中含有的杂质有锌、铁、铜、银,电解精炼后溶液中的金属阳离子有_______ 。
(4)制备硝酸铅时需要加热,但温度不宜过高,原因是_______ 。
II.含铅废水处理化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为:氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水样中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加 NaOH溶液又变澄清。

(5)若采用氢氧化物沉淀法除溶液中的Pb2+,应将溶液的pH调至约为_______ 。pH≥13 时,溶液中发生的主要离子方程式为_______ 。
(6)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致_______ 。 已知Ksp(PbS)=8.0×10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0 × 10-20mol/L,该废水中铅含量_______ (填“已经”或“尚未”)达到国家规定的排放标准。
I.以方铅矿(PbS)为原料制备铅的相关化合物的工艺流程如图所示:

(1)“焙烧”时,提高反应速率的措施有
(2)写出“高温还原”的主要化学方程式
(3)“粗铅”中含有的杂质有锌、铁、铜、银,电解精炼后溶液中的金属阳离子有
(4)制备硝酸铅时需要加热,但温度不宜过高,原因是
II.含铅废水处理化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为:氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水样中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加 NaOH溶液又变澄清。

(5)若采用氢氧化物沉淀法除溶液中的Pb2+,应将溶液的pH调至约为
(6)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致
您最近一年使用:0次
解题方法
9 . 已知海水中的溴含量约为65mg·L-1,从海水中提取溴的工业流程如图:

(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是__ 。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的___ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
________ Br2+________ CO =
=________ BrO +
+________ Br-+________ CO2↑
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为___ 。
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有__ (填字母)。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯

(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
 =
= +
+(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
您最近一年使用:0次
解题方法
10 . 某工厂将制革工业污泥中的铬元素以难溶物CrOH(H2O)5SO4的形式回收,工艺流程如下,其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
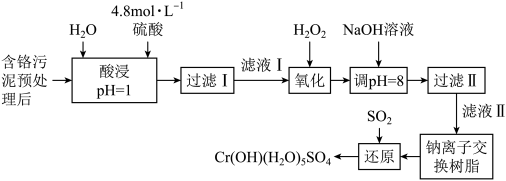
回答下列问题:
(1)4.8 mol/L的硫酸溶液密度为1.27g/cm3,该溶液中硫酸的质量分数是_______ 。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______ 。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
①Cr (OH)3溶解于NaOH溶液时反应的离子方程式是___________ 。
②加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有______ ;但溶液的pH不能超过8,其理由是______________________________ 。
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____________ 。
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________ 。

回答下列问题:
(1)4.8 mol/L的硫酸溶液密度为1.27g/cm3,该溶液中硫酸的质量分数是
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | — | — | — |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
②加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:
您最近一年使用:0次
2018-05-05更新
|
498次组卷
|
2卷引用:【全国市级联考】四川省攀枝花市2018届高三第三次统考理科综合化学试题



