名校
1 . A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。
Ⅰ.若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
Ⅱ.若向实验Ⅰ的四支试管中分别加盐酸,B盐溶液有沉淀产生E,D盐溶液有无色无味气体逸出。
根据实验Ⅰ、Ⅱ回答下列问题:
(1)C的名称为___________ ;D的化学式为______________ 。
(2)写出盐酸+B反应的离子方程式__________________ ,化学方程式与盐酸+D反应具有相同的离子方程式。
(3)将沉淀E过滤并洗涤,如何验证沉淀E已洗涤干净_____________________________ 。
(4)为检测C盐的一些性质,需配制240 mL 0.2 mol/L NaOH溶液,请回答下列问题:
①经计算,需用托盘天平称量固体NaOH的质量为__________ g。
②在配制NaOH溶液时除烧杯、玻璃棒外,还需使用的玻璃仪器有________ 和_________ 。
③将NaOH浓溶液先____________ ,再转移到容量瓶中,否则溶液浓度__________ (填“偏高”或“偏低”)。
④配制NaOH溶液时定容的操作:加蒸馏水距离刻度线__________ 处,改用_________ 滴加,至_______________ 与刻度线相切。
⑤取出配制好的溶液150mL,可以中和质量分数为36.5%,密度为1.20g/mL的盐酸的体积为____ mL,配制该盐酸需HCl的体积为________ mL(标准状况下)。
Ⅰ.若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
Ⅱ.若向实验Ⅰ的四支试管中分别加盐酸,B盐溶液有沉淀产生E,D盐溶液有无色无味气体逸出。
根据实验Ⅰ、Ⅱ回答下列问题:
(1)C的名称为
(2)写出盐酸+B反应的离子方程式
(3)将沉淀E过滤并洗涤,如何验证沉淀E已洗涤干净
(4)为检测C盐的一些性质,需配制240 mL 0.2 mol/L NaOH溶液,请回答下列问题:
①经计算,需用托盘天平称量固体NaOH的质量为
②在配制NaOH溶液时除烧杯、玻璃棒外,还需使用的玻璃仪器有
③将NaOH浓溶液先
④配制NaOH溶液时定容的操作:加蒸馏水距离刻度线
⑤取出配制好的溶液150mL,可以中和质量分数为36.5%,密度为1.20g/mL的盐酸的体积为
您最近一年使用:0次
名校
解题方法
2 . 按要求写方程式。
(1)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______ 。
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为______ 。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气(COCl2),其反应的化学方程式为_____ 。
(4)CeO2溶于稀硫酸和H2O2的混合溶液,得到Ce3+,写出离子方程式_____ 。
(5)NaClO3与盐酸反应生成ClO2及Cl2,写出方程式_____ 。
(6)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为____ 。
(7)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平。_____ 。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式____ 。
(8)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式。____ 。
(9)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式____ 。
(10)已知:①MnO4-+e-―→MnO42-(绿色)(强碱性条件)
②MnO4-+8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式____ 。
(1)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气(COCl2),其反应的化学方程式为
(4)CeO2溶于稀硫酸和H2O2的混合溶液,得到Ce3+,写出离子方程式
(5)NaClO3与盐酸反应生成ClO2及Cl2,写出方程式
(6)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为
(7)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式
(8)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式。
(9)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式
(10)已知:①MnO4-+e-―→MnO42-(绿色)(强碱性条件)
②MnO4-+8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式
您最近一年使用:0次
3 . 【化学—选修2化学与技术】煤是重要的能源,也是生产化工产品的重要原料。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为____ 和____ 。
(2)煤制油是一项新兴的、科技含量较高的煤化工技术,发展煤制油对我国而言具有重大意义。下列是煤制汽油和丙烯的主要工艺流程图。

①为了提高原料利用率,上述工艺中应控制合成气中V(CO):V(H2)=_____ 。
②采用MTG法生产的汽油中,均四甲苯(1,2,4,5-四甲基苯)质量分数约占4 %~7%,均四甲苯的结构简式为:__________________ 。
(3)利用煤的气化技术可获得合成氨的原料氢气,在制取原料气的过程中常混有一些杂质,其中某些杂质会使催化剂__________ ,必须除去。
①写出除去H2S杂质的反应方程式___________________________ 。
②欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2(g)+H2(g),已知850℃时该反应的平衡常数K=1,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于
CO2(g)+H2(g),已知850℃时该反应的平衡常数K=1,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于_____ 。
(4)煤做能源在燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
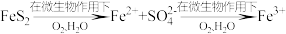
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为____ ,第二步反应的离子方程式为________ 。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为
(2)煤制油是一项新兴的、科技含量较高的煤化工技术,发展煤制油对我国而言具有重大意义。下列是煤制汽油和丙烯的主要工艺流程图。

①为了提高原料利用率,上述工艺中应控制合成气中V(CO):V(H2)=
②采用MTG法生产的汽油中,均四甲苯(1,2,4,5-四甲基苯)质量分数约占4 %~7%,均四甲苯的结构简式为:
(3)利用煤的气化技术可获得合成氨的原料氢气,在制取原料气的过程中常混有一些杂质,其中某些杂质会使催化剂
①写出除去H2S杂质的反应方程式
②欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)
 CO2(g)+H2(g),已知850℃时该反应的平衡常数K=1,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于
CO2(g)+H2(g),已知850℃时该反应的平衡常数K=1,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于(4)煤做能源在燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
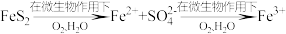
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为
您最近一年使用:0次
4 . 欲测定镁铝合金中金属铝的百分含量
Ⅰ:甲同学利用下图所给的仪器组成一套实验装置(仪器不一定全选,已知:室温时的气体摩尔体积为24.0 L/mol)。

填写下列各项(气流从左到右):
(1)装置中导管W的作用是_____________________________________ 。
(2)各种仪器的连接顺序(填接口字母)是_____________________ 。
(3)连接好仪器后,要进行以下操作,其先后顺序是_________ (填序号)。
①待装置中的温度恢复至室温;
②擦掉镁铝合金条表面的氧化膜,将其置于电子天平上称量质量为0.39 g,并将其投入锥形瓶中;
③检查装置的气密性;
④旋开装置A中分液漏斗的活塞,使其中的稀盐酸顺利流下,当合金条完全溶解时再关闭活塞,此时A中共加入稀盐酸10 mL;
⑤测得量筒中水的体积为480 mL。
(4)根据实验数据计算合金中铝的质量百分数______ (保留小数点后一位数字)。
(5)读数时除上述①注意事项外,还应有___________ (写出一点即可)。
Ⅱ:乙同学的方案:称量0.39 g 镁铝合金条,放在如图所示装置的惰性电热板上,通电使其灼烧。欲计算铝的百分含量,该实验还需要测定的数据是__________ 。丙同学提出该实验可能会存在较大误差,其理由是_____________________________ 。

Ⅲ:丁同学另称量3.9 g的同样的镁铝合金条,投入VmL 1mol/L的NaOH溶液中,充分反应后,过滤、洗涤、干燥、称量固体质量,再计算铝的含量,与甲同学的测量结果相同。写出发生反应的离子方程式________________________________ ,计算NaOH溶液的体积V≥ ________ mL。
Ⅰ:甲同学利用下图所给的仪器组成一套实验装置(仪器不一定全选,已知:室温时的气体摩尔体积为24.0 L/mol)。

填写下列各项(气流从左到右):
(1)装置中导管W的作用是
(2)各种仪器的连接顺序(填接口字母)是
(3)连接好仪器后,要进行以下操作,其先后顺序是
①待装置中的温度恢复至室温;
②擦掉镁铝合金条表面的氧化膜,将其置于电子天平上称量质量为0.39 g,并将其投入锥形瓶中;
③检查装置的气密性;
④旋开装置A中分液漏斗的活塞,使其中的稀盐酸顺利流下,当合金条完全溶解时再关闭活塞,此时A中共加入稀盐酸10 mL;
⑤测得量筒中水的体积为480 mL。
(4)根据实验数据计算合金中铝的质量百分数
(5)读数时除上述①注意事项外,还应有
Ⅱ:乙同学的方案:称量0.39 g 镁铝合金条,放在如图所示装置的惰性电热板上,通电使其灼烧。欲计算铝的百分含量,该实验还需要测定的数据是

Ⅲ:丁同学另称量3.9 g的同样的镁铝合金条,投入VmL 1mol/L的NaOH溶液中,充分反应后,过滤、洗涤、干燥、称量固体质量,再计算铝的含量,与甲同学的测量结果相同。写出发生反应的离子方程式
您最近一年使用:0次



