名校
解题方法
1 . 某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3 的过程如下:

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为________________ ;固体A 是___________ (填化学式),写出沉淀F 转化为氧化铝的化学方程式是___________________________ 。
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是__________ ;固体X的主要用途有(写出1条即可) _____ 。沉淀Z为_______ (填化学式)。由溶液K生成沉淀M的离子方程式是_________________________ 。
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________ (保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol 电子,反应的化学方程式是__________________ 。

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol 电子,反应的化学方程式是
您最近一年使用:0次
名校
解题方法
2 . 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加___ ,该过程的现象为____ 。
(2)步骤②加入过量H2O2的目的:_____ 。
(3)步骤③中反应的离子方程式:____ 。
(4)若实验无损耗,则每片补血剂含铁元素的质量____ g。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定:5Fe2++ +8H+=5Fe3++Mn2++4H2O,上述实验中的KMnO4溶液需要酸化,用于酸化的酸是
+8H+=5Fe3++Mn2++4H2O,上述实验中的KMnO4溶液需要酸化,用于酸化的酸是___ .
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
滴定终点的现象为_____ 。

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加
(2)步骤②加入过量H2O2的目的:
(3)步骤③中反应的离子方程式:
(4)若实验无损耗,则每片补血剂含铁元素的质量
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定:5Fe2++
 +8H+=5Fe3++Mn2++4H2O,上述实验中的KMnO4溶液需要酸化,用于酸化的酸是
+8H+=5Fe3++Mn2++4H2O,上述实验中的KMnO4溶液需要酸化,用于酸化的酸是a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
滴定终点的现象为
您最近一年使用:0次
解题方法
3 . 一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:

(1)锶与钙元素同主族。金属锶应保存在_______ 中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为__________ 。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是______ 。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为____________ ,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是_____ 。
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式__________ 。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是______ (填标号)。
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为________ 。

(1)锶与钙元素同主族。金属锶应保存在
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为
| 质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
| Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
| Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为
您最近一年使用:0次
2020-04-12更新
|
299次组卷
|
2卷引用:广东省深圳市2020届高三下学期第二次线上测试(全国I卷)理综化学试题
解题方法
4 . 天然脑砂含少量NH4Cl,《唐本草》记载脑砂入药可以散瘀消肿。某学习小组设计下列步骤制取NH4Cl,并进行天然脑砂含量的测定。请回答相关问题:
步骤Ⅰ用氨气与适量氯气反应制取NH4Cl
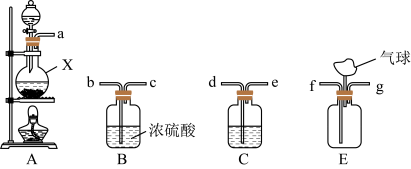
(1)装置A中仪器X的名称为___ ;若用浓盐酸与MnO2反应制取氯气,则该反应的离子方程式为___ 。
(2)C中盛放的试剂是___ ;要得到干燥纯净的氯气,按照气流由左到右的顺序,上述A、B、C装置连接依次为a→___ (用小写字母表示)。
(3)氨气与适量氯气混合反应可生成NH4Cl和一种无污染的气体,利用E装置模拟该反应。氨气应从___ (用小写字母表示)通入,反应的化学方程式为___ ;观察到的现象是___ 。
步骤Ⅱ天然脑砂中NH4Cl含量的测定
准确称取一定质量脑砂,与足量的氧化铜混合,如图所示进行实验。
已知:2NH4Cl+3CuO 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
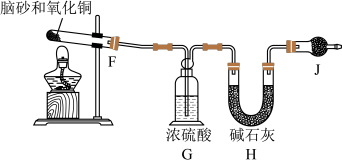
(4)为完成NH4Cl含量的测定,请完成下列实验步骤:
加热前,称量H装置的总质量;当观察到___ 现象时,停止加热,冷却,___ 。
(5)如果不用J装置,测出NH4Cl的含量将___ (填“偏高”、“偏低”或“无影响”)。
步骤Ⅰ用氨气与适量氯气反应制取NH4Cl

(1)装置A中仪器X的名称为
(2)C中盛放的试剂是
(3)氨气与适量氯气混合反应可生成NH4Cl和一种无污染的气体,利用E装置模拟该反应。氨气应从
步骤Ⅱ天然脑砂中NH4Cl含量的测定
准确称取一定质量脑砂,与足量的氧化铜混合,如图所示进行实验。
已知:2NH4Cl+3CuO
 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
(4)为完成NH4Cl含量的测定,请完成下列实验步骤:
加热前,称量H装置的总质量;当观察到
(5)如果不用J装置,测出NH4Cl的含量将
您最近一年使用:0次
名校
5 . 海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
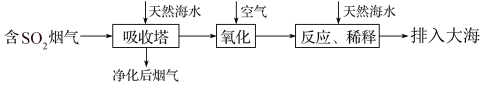

| A.工艺中天然海水显酸性 |
| B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42- |
| C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化 |
| D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高 |
您最近一年使用:0次
2019-10-30更新
|
228次组卷
|
6卷引用:福建省莆田市莆田第二十五中学2020届高三上学期期中考试化学试题
10-11高三上·福建南平·阶段练习
名校
解题方法
6 . 北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式_______(将化学计量数填于空白处)
_______ KIO3+_______ KI+_______ H2SO4=_______ K2SO4+_______ I2+_______ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式_______ 。
(3)已知:I2+2S2O =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______ 。
②b中反应所产生的I2的物质的量是_______ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_______ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式
(3)已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
您最近一年使用:0次
解题方法
7 . 平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质),某小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有氧化性。
(1)滤液A的主要成分_____ (填写化学式),滤液B所含金属阳离子为________ 。
(2)反应①的离子方程式是_________ 。
(3)反应①之前要洗涤滤渣B,对滤渣B进行“洗涤”的实验操作方法是________ 。
(4)反应②的化学反应方程式是____________ 。
(5)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液萃取出来,过程表示为Ce2(SO4)3(水层)+ 6HT(有机层) CeT3(有机层)+3H2SO4(水层),用
CeT3(有机层)+3H2SO4(水层),用________ (填主要仪器)分液的到CeT3(有机层),再加入H2SO4获得较纯净的含Ce3+的水溶液。可选择硫酸作反萃取的原因是________ 。
(6)用滴定法测定制得的Ce2(SO4)3产品纯度。

若所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得Ce(OH)4产品的质量分数______ 。(填“偏大”、“偏小”或“无影响”)

已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有氧化性。
(1)滤液A的主要成分
(2)反应①的离子方程式是
(3)反应①之前要洗涤滤渣B,对滤渣B进行“洗涤”的实验操作方法是
(4)反应②的化学反应方程式是
(5)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液萃取出来,过程表示为Ce2(SO4)3(水层)+ 6HT(有机层)
 CeT3(有机层)+3H2SO4(水层),用
CeT3(有机层)+3H2SO4(水层),用(6)用滴定法测定制得的Ce2(SO4)3产品纯度。

若所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得Ce(OH)4产品的质量分数
您最近一年使用:0次
8 . 铝鞣剂[主要成分为Al(OH)2Cl]主要用于鞣制皮革.利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂的一种工艺如图:

回答下列问题:
(1)气体A为_____ (填化学式).水解采用90℃而不在室温下进行的原因是_____ .
(2)酸溶时使用的酸是_____ (填名称).
(3)氧化时,发生反应的离子方程式为_____ .
(4)除杂时产生废渣的主要成分为_____ (填化学式),对其合理的处理方法是_____ .
(5)采用喷雾干燥而不用蒸发的原因是_____ .
(6)准确称取所制备的铝鞣剂m g,将其置于足量硝酸中,待样品完全溶解后,加入足量AgNO3溶液,充分反应,过滤、洗涤、干燥得固体ng.则样品中Al(OH)2Cl的质量分数为_____ (用含m、n的代数式表示)

回答下列问题:
(1)气体A为
(2)酸溶时使用的酸是
(3)氧化时,发生反应的离子方程式为
(4)除杂时产生废渣的主要成分为
(5)采用喷雾干燥而不用蒸发的原因是
(6)准确称取所制备的铝鞣剂m g,将其置于足量硝酸中,待样品完全溶解后,加入足量AgNO3溶液,充分反应,过滤、洗涤、干燥得固体ng.则样品中Al(OH)2Cl的质量分数为
您最近一年使用:0次
名校
9 . 现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素。请回答下列问题:

(1)写出金属B和气体丙的化学式__________ 、_________ 。
(2)写出反应①的化学反应方程式______________________________ ,写出反应⑤的离子方程式__________________________________ 。
(3)用溶液G与铜反应可制作印刷电路板,其离子方程式_____________ 。

(1)写出金属B和气体丙的化学式
(2)写出反应①的化学反应方程式
(3)用溶液G与铜反应可制作印刷电路板,其离子方程式
您最近一年使用:0次
名校
解题方法
10 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
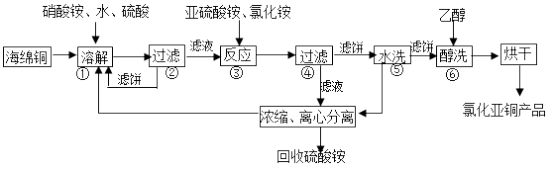
回答下列问题:
(1)步骤①中得到的氧化产物是_______ (填离子符号),溶解温度应控制在60~70℃,原因是________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是_____________ 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
2016-01-07更新
|
226次组卷
|
2卷引用:2016届福建省师大附中高三上学期期中考试化学试卷



