1 . A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):

(1)Y的电子式为________ ,构成E单质的元素在周期表中位于第________ 周期第_________________ 族
(2)反应①的离子方程式为__________________________
反应②的离子方程式为_________________
反应③的离子方程式为__________________________
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式_________________
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:_________________
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为__________________ (保留到小数点后两位)。

(1)Y的电子式为
(2)反应①的离子方程式为
反应②的离子方程式为
反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
2016-12-09更新
|
392次组卷
|
3卷引用:2017届河北省衡水中学高三小二调考化学试卷
2014·陕西西安·二模
名校
2 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
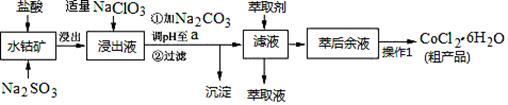
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_________________ 。
(2)写出NaClO3发生反应的主要离子方程式________________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为___________________ 。
(4)“操作1”中包含3个基本实验操作,它们依次是_____________ 、____________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是______________ ;其使用的最佳pH范围是_________ 。
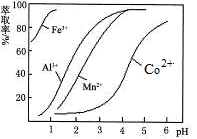
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________________ 。(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为
(4)“操作1”中包含3个基本实验操作,它们依次是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
6卷引用:河北省保定市曲阳一中2020届高三上学期第一次月考化学试题
名校
3 . CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为______ 。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______ 。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是__________ 。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________ 。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2 g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为_______ ,所得溶液的物质的量浓度为______ 。
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需___________________ 。

(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O
 Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2 g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需

您最近一年使用:0次
名校
解题方法
4 . 电力工业所需的钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:

已知:i.酸洗钢制构件后得到废酸的主要成分如下表所示。
ii pH <4时,Fe2+不易被氧气氧化。
(1)酸洗钢制构件时发生反应的离子方程式:2H++ FeO=Fe2++H2O、___________ 。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq) FeSO4(s)+2HCl(aq)。加入过量H2SO4的作用是
FeSO4(s)+2HCl(aq)。加入过量H2SO4的作用是___________ (至少写出两点)。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是___________ 。
(4)过程IV发生反应的离子方程式是___________ 。
(5)H2O2是一种常用的绿色氧化剂,ClO2也具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的___________ 倍。
(6)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X- RX +OH-(X 表示FeCl4)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:
RX +OH-(X 表示FeCl4)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:
 Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液的pH将会___________ 。(填“升高”、“降低”或“不变”)
②洗脱液经处理后有许多用途,下列用途合理的是___________ 。
A、刻蚀印刷铜线路板 B、净化污水 C、自来水消毒 D、浸泡生物标本

已知:i.酸洗钢制构件后得到废酸的主要成分如下表所示。
成分 | Cl- | 游离HCl | Fe2+ | Fe3+ |
含量/g·L-1 | 130-160 | 50-70 | 60-80 | 0 |
(1)酸洗钢制构件时发生反应的离子方程式:2H++ FeO=Fe2++H2O、
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq)
 FeSO4(s)+2HCl(aq)。加入过量H2SO4的作用是
FeSO4(s)+2HCl(aq)。加入过量H2SO4的作用是(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是
(4)过程IV发生反应的离子方程式是
(5)H2O2是一种常用的绿色氧化剂,ClO2也具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(6)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X-
 RX +OH-(X 表示FeCl4)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:
RX +OH-(X 表示FeCl4)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:
 Fe3+ +4C1-。
Fe3+ +4C1-。①吸附后溶液的pH将会
②洗脱液经处理后有许多用途,下列用途合理的是
A、刻蚀印刷铜线路板 B、净化污水 C、自来水消毒 D、浸泡生物标本
您最近一年使用:0次
名校
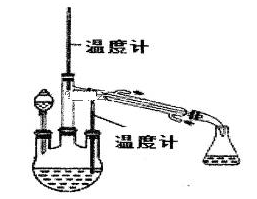
5 . 水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
步骤1:制备NaClO溶液。已知:3NaClO NaCl+NaClO3
NaCl+NaClO3
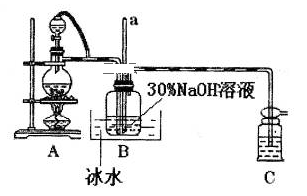
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_______ (填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是__________ ;若装置C中出现堵塞,玻璃管a中的现象为_______________ ;B中用冰水浴控制温度在30℃以下,其主要目的是______________ 。
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)。
(3)分液漏斗中的溶液是___________ (填“A”或“B”);
A.NaOH和NaClO混合溶液 B.CO(NH2)2溶液
步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为_______________ 。
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为_______________________________________ ;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为__________ 。(保留三位有效数字)
步骤1:制备NaClO溶液。已知:3NaClO
 NaCl+NaClO3
NaCl+NaClO3
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)。
(3)分液漏斗中的溶液是
A.NaOH和NaClO混合溶液 B.CO(NH2)2溶液

步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为
您最近一年使用:0次
2019-01-27更新
|
167次组卷
|
2卷引用:河北省承德第一中学2020届高三9月月考化学试题
名校
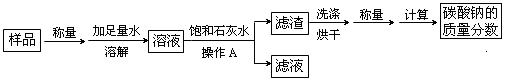
6 . 某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验:
请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有_______________ 、_______________ ;
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是_____________________ 。
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含_________________ (填溶质的化学式,下同),若有气泡产生,那么测定的样品中碳酸钠的质量分数___________ (填偏大、偏小、无影响)。
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有的溶质是________ ;滴加盐酸的过程中一定发生反应的离子方程式为 ___________________________________ 。

请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有的溶质是
您最近一年使用:0次
2018-12-26更新
|
122次组卷
|
3卷引用:2015-2016学年河北省隆化县存瑞中学高一上学期第二次月考化学试卷
2015-2016学年河北省隆化县存瑞中学高一上学期第二次月考化学试卷河北省承德市隆化县存瑞中学2018-2019学年高一上学期第二次质检化学试题(已下线)专题36 碳酸钠质量分数测定的实验探究-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
解题方法
7 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_______ ,其中水为________ 剂。

(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
____ CuO+____ NH4Cl 
____ Cu+____ CuCl2+____ N2↑+____ H2O
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______ (填元素名称),氧化剂是______ (填化学式)。
③反应中若产生0.2mol的气体,则有________ mol的电子转移。
(3)写出下列反应的离子方程式。
①NaHCO3溶于醋酸:____________________
②过量CO2与NaOH溶液反应:____________________
③Al(OH)3溶于NaOH溶液中:___________________
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。试写出有水参加的符合反应类型Ⅳ的一个化学方程式:

(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:

①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是
③反应中若产生0.2mol的气体,则有
(3)写出下列反应的离子方程式。
①NaHCO3溶于醋酸:
②过量CO2与NaOH溶液反应:
③Al(OH)3溶于NaOH溶液中:
您最近一年使用:0次
名校
解题方法
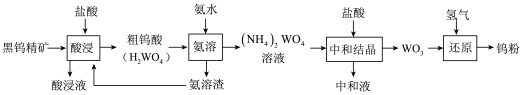
8 . 金属钨广泛用于冶金、机械、建筑、电子等领域。以黑钨精矿为原料冶炼钨的流程如图所示:
请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为_____ 。
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为_____ 。
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3的化学方程式为_____ ,所得“中和 液”的主要溶质的电子式为_____ 。
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为__________ 。
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是_____ ;
②样品中钛的含量为_____ %(用含 w、c、V 的式子表示)。

请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3的化学方程式为
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是
②样品中钛的含量为
您最近一年使用:0次
9 . 将10 g Fe2O3、SiO2、Al2O3的混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液的体积关系如图所示。下列叙述错误的是
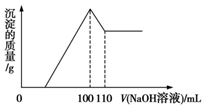

| A.滤出的物质为SiO2 |
| B.可求出x的值 |
| C.可求出Al2O3的质量分数 |
| D.可求出Fe2O3的质量分数 |
您最近一年使用:0次
2016-12-09更新
|
332次组卷
|
6卷引用:2017届河北省石家庄市辛集中学高三上第一次阶段考试化学卷
2017届河北省石家庄市辛集中学高三上第一次阶段考试化学卷2015年湖北省荆门市高三元月调考理综化学试卷(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密2019年秋高三化学复习强化练习—— 硅及其化合物(已下线)上海市杨浦区2011届高三4月模拟(二模)化学试题(已下线)上海市宝山区2011届高三4月模拟(二模)化学试题
10 . 将1.66 g碳酸钠和氢氧化钠的固体混合物完全溶于水配成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示。

请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有_________ (填化学式)。
(2)当到达B点时,产生CO2的体积为________________ mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数________________ 。(写出必要计算过程,结果保留3位有效数字)

请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有
(2)当到达B点时,产生CO2的体积为
(3)计算原混合物中Na2CO3的质量分数
您最近一年使用:0次
2016-12-09更新
|
688次组卷
|
2卷引用:2014-2015河北省邯郸市高一上学期期末考试化学试卷



