解题方法
1 . I、在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的 、
、 、
、 、
、 试分析:
试分析:

 该废液中可能大量存在的一种阴离子是
该废液中可能大量存在的一种阴离子是____  选填序号
选填序号 .
.
A.



 检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是
检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是_____________ ,铝元素发生变化的离子方程式是____________________________________________ 。
 为了回收废液中的金属银,某同学设计了如下方案:若依该方案获得银
为了回收废液中的金属银,某同学设计了如下方案:若依该方案获得银 ,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气
,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气________ L。
II、某无色透明溶液,投入金属铝可放出 。现有下列离子:
。现有下列离子: 、
、 、
、 、
、 、
、 、
、 、
、 、
、 。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
 当生成
当生成 时,可存在的离子有
时,可存在的离子有________________________________ ;
 当生成
当生成 时,可存在的离子有
时,可存在的离子有______________________________ 。
 、
、 、
、 、
、 试分析:
试分析:
 该废液中可能大量存在的一种阴离子是
该废液中可能大量存在的一种阴离子是 选填序号
选填序号 .
.A.




 检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是
检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是 为了回收废液中的金属银,某同学设计了如下方案:若依该方案获得银
为了回收废液中的金属银,某同学设计了如下方案:若依该方案获得银 ,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气
,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气II、某无色透明溶液,投入金属铝可放出
 。现有下列离子:
。现有下列离子: 、
、 、
、 、
、 、
、 、
、 、
、 、
、 。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
。试判断下列两种情况时,各有哪些离子可存在于此溶液中: 当生成
当生成 时,可存在的离子有
时,可存在的离子有 当生成
当生成 时,可存在的离子有
时,可存在的离子有
您最近一年使用:0次
9-10高三·江苏·阶段练习
2 . 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
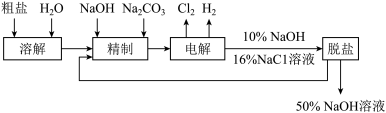
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应式为__________ 。 与电源负极相连的电极附近,溶液pH ________ (选填:不变,升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________ ,
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______ 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________ 。
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________ 、冷却、_________ (填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷 的食盐水时,Cl2与NaOH充分接触,产物仅是 NaClO和H2,相应的化学方程式为_____ 。

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应式为
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解
您最近一年使用:0次
2020-03-05更新
|
394次组卷
|
8卷引用:2015-2016学年吉林省松原高中、白城一中高二上期末联考化学试卷
2015-2016学年吉林省松原高中、白城一中高二上期末联考化学试卷(已下线)江苏省2011届高三化学一轮过关测试(7)(已下线)同步君 选修4 第4章 第3节 电解原理的应用高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)(已下线)2018年12月3日 《每日一题》人教选修4-电解饱和食盐水山东省枣庄市滕州市第一中学2019-2020学年高二下学期学习竞赛化学试题北京市通州区2019-2020学年高二下学期期末考试化学试题宁夏石嘴山市第三中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
3 . 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____ 。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____ 。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__ 。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

(1)原混合物中NaOH的质量是____ g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___ mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:

用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000mol⋅L−1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I−+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___ g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___ (填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁

(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |

(1)原混合物中NaOH的质量是
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:

用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000mol⋅L−1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I−+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
您最近一年使用:0次
2019-09-21更新
|
134次组卷
|
2卷引用:吉林延边二中2020届高三9月化学考试题
4 . 工业上可用以下方案使饮用水中NO3-含量达标。

请回答下列问题:
(1)调节pH不宜过大或过小,否则会造成Al的利用率降低;试剂X可选用____ (填序号)。
(2)流程中操作①的名称为______ ,若在实验室中进行此操作,所需要的玻璃仪器是_______ 。
(3)写出溶液中铝粉和NO3-反应的离子方程式:____ 。
(4)还可用以下化学反应使饮用水中NO3-含量达标,产物之一是空气的主要成分。完成下列离子方程式:____ H2+____ NO3-+____ ____ 
____ ____ +____ H2O

请回答下列问题:
(1)调节pH不宜过大或过小,否则会造成Al的利用率降低;试剂X可选用
| A.NaOH | B.Ca(OH)2 | C.NH3.H2O | D.CuO E.CO2 |
(3)写出溶液中铝粉和NO3-反应的离子方程式:
(4)还可用以下化学反应使饮用水中NO3-含量达标,产物之一是空气的主要成分。完成下列离子方程式:

您最近一年使用:0次
2019-01-30更新
|
37次组卷
|
2卷引用:2015-2016学年吉林省吉林一中高一下期末化学试卷
名校
解题方法
5 . 碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
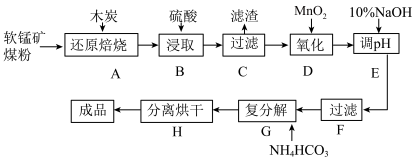
已知:还原焙烧主反应为:2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为________________ ,步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为_________ 。
(2)步骤C中得到的滤渣主要成分是_______________ ,步骤D中还原剂与氧化剂的物质的量之比为__________ 。
(3)步骤E中调节pH的范围为________ ,其目的是_____________________________ 。
(4)步骤G的离子方程式为___________________ ,若Mn2+沉淀完全时测得溶液中 的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=
的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=__________ 。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++ +H2O→H++
+H2O→H++ +
+ ,
,
①请配平上述离子方程式____________________________ ;
②确认Mn2+离子已经完全反应的现象是_______________________________ 。

已知:还原焙烧主反应为:2MnO2+C
 2MnO+CO2↑。
2MnO+CO2↑。可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为
(2)步骤C中得到的滤渣主要成分是
(3)步骤E中调节pH的范围为
(4)步骤G的离子方程式为
 的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=
的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++
 +H2O→H++
+H2O→H++ +
+ ,
,①请配平上述离子方程式
②确认Mn2+离子已经完全反应的现象是
您最近一年使用:0次
名校
6 . 铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。

讨论回答下列问题:
(1)①中加盐酸后的沉淀主要是___________ (化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________ (一种即可)。
(2)写出②、③中可能发生反应的离子方程式。
②_______________________ 、________________ 、_______________________ 、________________ 。
③_____________________ 、________________ 。
(3)步骤②中不用氨水沉淀Fe3+的原因:_____________ 。

讨论回答下列问题:
(1)①中加盐酸后的沉淀主要是
(2)写出②、③中可能发生反应的离子方程式。
②
③
(3)步骤②中不用氨水沉淀Fe3+的原因:
您最近一年使用:0次
2019-01-30更新
|
313次组卷
|
2卷引用:吉林省长春外国语学校2018-2019学年高二下学期期末考试化学试题
7 . 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有__________________ 。
(2)加MgO后过滤所得滤渣的主要成分为________________________ 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为_________________________ 。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:____________________________ ;
②产品中Mg(ClO3)2·6H2O的质量分数为____________ 。

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有
(2)加MgO后过滤所得滤渣的主要成分为
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O
 +6Fe2++14H+=2Cr3++6Fe3++7H2O。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:
②产品中Mg(ClO3)2·6H2O的质量分数为
您最近一年使用:0次
8 . 肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。

实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH溶液的锥形瓶中,锥形瓶中发生反应的离子方程式为________________ 。
实验二:制取水合肼(实验装置如图所示)
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)
(2)仪器X的名称是___________ ;分液漏斗中的溶液是___________ (填“A”或“B”);
A.NaOH和NaClO混合溶液
B.CO(NH2)2溶液
选择的理由是_____________________________ 。
实验三:测定馏分中水合肼的质量分数
水合肼具有还原性,被氧化生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液。
b.移取25.00 mL溶液于锥形瓶中,加入10 mL水,摇匀。
c.用0.2000 mol·L-1碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为_________________________________ ;
测定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是______________________ 。
(4)滴定时,碘的标准溶液盛放在___________ (填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00 mL,则馏分中水合肼(N2H4·H2O)的质量分数为________ (保留三位有效数字)。

实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH溶液的锥形瓶中,锥形瓶中发生反应的离子方程式为
实验二:制取水合肼(实验装置如图所示)
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)
(2)仪器X的名称是
A.NaOH和NaClO混合溶液
B.CO(NH2)2溶液
选择的理由是
实验三:测定馏分中水合肼的质量分数
水合肼具有还原性,被氧化生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液。
b.移取25.00 mL溶液于锥形瓶中,加入10 mL水,摇匀。
c.用0.2000 mol·L-1碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为
测定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(4)滴定时,碘的标准溶液盛放在
您最近一年使用:0次
9 . 某探究性学习小组设计如右图所示装置分别进行如下探究实验,请回答下列问题:

(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是 ;
(2)实验Ⅱ中量气管中的液体最好是 (填字母编号, 下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是 ;

(3)①写出实验Ⅲ中涉及的离子反应方程式 ;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是 ,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。实验前,如拆去导管D,测得的气体体积将 (填“偏大”、“偏小”、或“无影响”)。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
根据上述数据,计算出镁铝合金中铝的质量分数为 。

| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是 ;
(2)实验Ⅱ中量气管中的液体最好是 (填字母编号, 下同)
A.NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是 ;

(3)①写出实验Ⅲ中涉及的离子反应方程式 ;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是 ,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。实验前,如拆去导管D,测得的气体体积将 (填“偏大”、“偏小”、或“无影响”)。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为 。
您最近一年使用:0次
名校
10 . 三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
(1)氯化水解法生产三氯氧磷的化学方程式为_____________________________________ 。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用10 mL H3PO3溶液与同浓度的NaOH溶液20 mL恰好完全反应,生成的盐化学式为___________ ,属于________ (填“正盐”或“酸式盐”)。
②H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________ 。
③用含有Ca2+的溶液处理含磷废水,若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________ mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
④某温度下,0.1mol/L的H3PO3溶液中c(H+)=2.5×10ˉ2 mol/L,则该温度下H3PO3的第一步电离的平衡常数Kal=___________ (H3PO3的第二步电离忽略不计,保留两位有效数字)。
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,进一步可以计算产品的纯度,
实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入b mol·Lˉ1的AgNO3溶液V1 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,振荡,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,所用体积V2 mL。
①滴定选用的指示剂是________ (选填字母)。
a.Fe2(SO4)3 b.(NH4)2Fe(SO4)2 c.淀粉 d.酚酞
②实验所测产品中三氯氧磷的纯度为_____________ 。(用含相关字母的表达式表示)

(1)氯化水解法生产三氯氧磷的化学方程式为
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用10 mL H3PO3溶液与同浓度的NaOH溶液20 mL恰好完全反应,生成的盐化学式为
②H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式
③用含有Ca2+的溶液处理含磷废水,若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=
④某温度下,0.1mol/L的H3PO3溶液中c(H+)=2.5×10ˉ2 mol/L,则该温度下H3PO3的第一步电离的平衡常数Kal=
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,进一步可以计算产品的纯度,
实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入b mol·Lˉ1的AgNO3溶液V1 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,振荡,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,所用体积V2 mL。
①滴定选用的指示剂是
a.Fe2(SO4)3 b.(NH4)2Fe(SO4)2 c.淀粉 d.酚酞
②实验所测产品中三氯氧磷的纯度为
您最近一年使用:0次



