解题方法
1 . 过碳酸钠(Na2CO4)是化工上常用的漂白剂和氧化剂,该产品中常常含有纯碱杂质,实验室在常温常压下利用如图所示装置测定过碳酸钠样品的纯度。
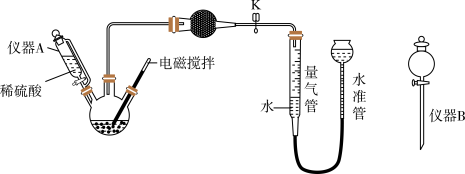
已知:常温常压下,气体摩尔体积约为24.5 L·mol-1;实验过程中取mg样品。
回答下列相关问题:
(1)仪器A的名称为_______ ;干燥管中装入的试剂为________ 。
(2)过碳酸钠易溶解于水,可以与酸反应生成两种气体,写出过碳酸钠与过量的稀硫酸反应的离子反应方程式:_________ 。
(3)实验过程中使用电磁搅拌的目的是__________ 。
(4)气体生成结束后,水准管中的液面会高于量气管中的液面,此时需要将水准管慢慢向下移动,则量气管中的液面会________ (填“上升”或“下降”),原因是__________ 。
(5)最终测量反应生成氧气的体积为Vml,用m、V表示的样品的纯度(质量分数)为______ 。
(6)下列实验操作,可能会造成测定误差,若使用仪器B代替仪器A,则测定的纯度会____ (填“偏高”、“偏低”或“无影响”,下同);反应结束后,没有调节水准管与量气管的液面就直接读取量气管中的气体体积,则测定的纯度会_______ 。

已知:常温常压下,气体摩尔体积约为24.5 L·mol-1;实验过程中取mg样品。
回答下列相关问题:
(1)仪器A的名称为
(2)过碳酸钠易溶解于水,可以与酸反应生成两种气体,写出过碳酸钠与过量的稀硫酸反应的离子反应方程式:
(3)实验过程中使用电磁搅拌的目的是
(4)气体生成结束后,水准管中的液面会高于量气管中的液面,此时需要将水准管慢慢向下移动,则量气管中的液面会
(5)最终测量反应生成氧气的体积为Vml,用m、V表示的样品的纯度(质量分数)为
(6)下列实验操作,可能会造成测定误差,若使用仪器B代替仪器A,则测定的纯度会
您最近一年使用:0次
2 . 现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
请根据下列叙述回答问题:
(1)C的化学式为___ 。
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为___ 。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___ ,鉴别溶液中B的阴离子的试剂为___ 。
②D溶于稀硝酸的离子方程式为___ 。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___ 。
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为
②D溶于稀硝酸的离子方程式为
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为
您最近一年使用:0次
名校
3 . 乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往 A、B 两支试管中均加入 4 mL 0.01 mol·L-1的酸性 KMnO4溶液和 2 mL 0.1mol·L-1H2C2O4(乙二酸)溶液,振荡,A 试管置于热水中,B 试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间 tA________ tB(填“>”“=”或“<”)。写出该反应的离子方程式:___________________________ 。
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制 250 mL 溶液:准确称量 5.0 g 乙二酸样品,配成 250 mL 溶液。
②滴定:准确量取 25.00 mL 所配溶液于锥形瓶中,加少量酸酸化,将 0.100 0mol·L-1KMnO4标准溶液装入______ (填“酸式”或“碱式”)滴定管,进行滴定操作。 判断滴定达到终点的现象是_____________________ 。
③计算:重复上述操作 2 次,记录实验数据如下表。则消耗 KMnO4标准溶液的平均体积为________ mL,此样品的纯度为____________ 。
④误差分析:下列操作会导致测定结果偏高的是___________ 。
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往 A、B 两支试管中均加入 4 mL 0.01 mol·L-1的酸性 KMnO4溶液和 2 mL 0.1mol·L-1H2C2O4(乙二酸)溶液,振荡,A 试管置于热水中,B 试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间 tA
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理来测定其含量,具体操作为:
①配制 250 mL 溶液:准确称量 5.0 g 乙二酸样品,配成 250 mL 溶液。
②滴定:准确量取 25.00 mL 所配溶液于锥形瓶中,加少量酸酸化,将 0.100 0mol·L-1KMnO4标准溶液装入
③计算:重复上述操作 2 次,记录实验数据如下表。则消耗 KMnO4标准溶液的平均体积为
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用KMnO4标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
2020-10-15更新
|
403次组卷
|
6卷引用:安徽省阜阳市太和第一中学2020-2021学年高二上学期10月月考化学试题
名校
解题方法
4 . 已知实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
(1)该反应中氧化剂是__________ (填化学式,下同),被氧化的元素是_______ 元素。
(2)用单线桥法表示电子转移的方向和数目:_______
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(3)有一种“地康法”制取氯气的反应原理如图所示:

①反应Ⅰ的离子方程式为____________ 。
②反应Ⅱ属于_______ 反应。(填四种基本反应类型之一)
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式_______ 。
 MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:(1)该反应中氧化剂是
(2)用单线桥法表示电子转移的方向和数目:
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(3)有一种“地康法”制取氯气的反应原理如图所示:

①反应Ⅰ的离子方程式为
②反应Ⅱ属于
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式
您最近一年使用:0次
2020-10-15更新
|
147次组卷
|
2卷引用:湖南省张家界市民族中学2020-2021学年高一10月月考化学试题
名校
解题方法
5 . 有7种短周期元素的原子序数按A、B、C、D、E、F、G 的顺序依次增大,B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒,D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30,E、F、G的最高价氧化物对应的水化物之间可以相互反应,G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________ 。
(2)A和D可形成化合物的化学式为__________________ 。
(3)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为___________ 。
(5)写出D 元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_______________ 。
(1)C元素的原子结构示意图
(2)A和D可形成化合物的化学式为
(3)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为
(4)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为
(5)写出D 元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:
您最近一年使用:0次
14-15高三上·湖南衡阳·阶段练习
名校
解题方法
6 . 茶是我国人民喜爱的饮品。我市某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
已知:草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

请根据上述过程及信息填空:
(1)步骤②加盐酸的作用是________________ 。
(2)写出检验Ca2+的离子方程式__________________________ 。
(3)写出沉淀C所含主要物质的化学式________________________ 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式__________________________ 。
(5)步骤⑨的作用是_____________________________________ 。
(6)称取400 g茶叶样品灼烧得灰粉后,加入过量盐酸后过滤,将所得滤液加入过量的(NH4)2C2O4溶液,再过滤、洗涤、干燥、称量得到5.12 g沉淀,原茶叶中钙元素的质量分数为________ 。
已知:草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

请根据上述过程及信息填空:
(1)步骤②加盐酸的作用是
(2)写出检验Ca2+的离子方程式
(3)写出沉淀C所含主要物质的化学式
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式
(5)步骤⑨的作用是
(6)称取400 g茶叶样品灼烧得灰粉后,加入过量盐酸后过滤,将所得滤液加入过量的(NH4)2C2O4溶液,再过滤、洗涤、干燥、称量得到5.12 g沉淀,原茶叶中钙元素的质量分数为
您最近一年使用:0次
名校
7 . 铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。

讨论回答下列问题:
(1)①中加盐酸后的沉淀主要是___________ (化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________ (一种即可)。
(2)写出②、③中可能发生反应的离子方程式。
②_______________________ 、________________ 、_______________________ 、________________ 。
③_____________________ 、________________ 。
(3)步骤②中不用氨水沉淀Fe3+的原因:_____________ 。

讨论回答下列问题:
(1)①中加盐酸后的沉淀主要是
(2)写出②、③中可能发生反应的离子方程式。
②
③
(3)步骤②中不用氨水沉淀Fe3+的原因:
您最近一年使用:0次
2019-01-30更新
|
313次组卷
|
2卷引用:【校级联考】湖南省岳阳县第一中学、汨罗市一中2018-2019学年高一上学期期末考试化学试题
8 . 某化学兴趣小组在老师的指导下,设计了如图所示的实验装置。实验时将A、D中产生的气体同时通入C中。(部分夹持仪器已略去)回答下列问题:

(1)简述实验前检查A部分装置的气密性的方法_____ 。
(2)仪器E的名称是____ ,锥形瓶内小试管F的作用是 _____ 。
(3)若b是生石灰,a是_ 时,在C中有白烟产生,写出生成白烟的化学方程式_ 。
(4)若a是质量分数为75%的硫酸,b是亚硫酸钠粉末,在C中盛适量的BaCl2溶液时,写出C中发生反应的离子方程式____ 。
(5)从环保的角度出发,上述实验装置中需要改进的是____ 。

(1)简述实验前检查A部分装置的气密性的方法
(2)仪器E的名称是
(3)若b是生石灰,a是
(4)若a是质量分数为75%的硫酸,b是亚硫酸钠粉末,在C中盛适量的BaCl2溶液时,写出C中发生反应的离子方程式
(5)从环保的角度出发,上述实验装置中需要改进的是
您最近一年使用:0次
真题
解题方法
9 . 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________ 。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。
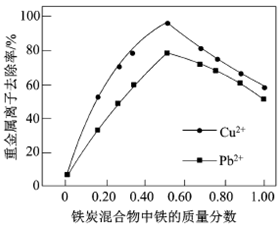
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________ 。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________ 。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为_________________ 。
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是_________ 。
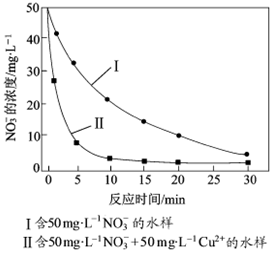
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是__________________ 。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是

您最近一年使用:0次
2016-12-09更新
|
1000次组卷
|
4卷引用:2017届湖南省长沙市长郡中学高三上学期第三次月考模拟化学试卷
名校
解题方法
10 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
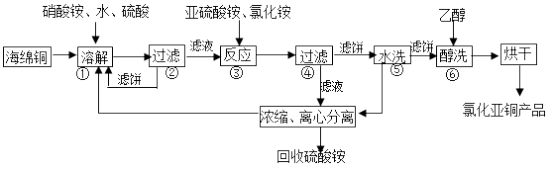
回答下列问题:
(1)步骤①中得到的氧化产物是_______ (填离子符号),溶解温度应控制在60~70℃,原因是________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是_____________ 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
2016-01-07更新
|
226次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2020届高三第4次月考化学试题



