解题方法
1 . 下列指定反应的离子方程式正确的是
| A.Fe2O3溶于稀硫酸:Fe2O3+6H+=2Fe2++3H2O |
B.盐酸溶解CaCO3: +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
C.H2SO4溶液与Ba(OH)2溶液反应:Ba2++ =BaSO4↓ =BaSO4↓ |
| D.过氧化钠样品溶于水:2Na2O2+2H2O=4Na++4OH-+O2↑ |
您最近一年使用:0次
解题方法
2 . 下列离子方程式正确的是
A.向稀硫酸中加入铁粉: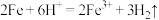 |
B.向 溶液中通入少量 溶液中通入少量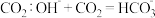 |
C.将少量 投入水中: 投入水中: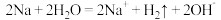 |
D.向 中滴加稀盐酸: 中滴加稀盐酸: |
您最近一年使用:0次
解题方法
3 . 下列反应的离子方程式书写正确的是
A.Fe和稀盐酸反应: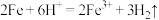 |
B.铜粉与稀硝酸的反应: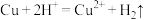 |
C.氯气与碘化钾溶液的反应: |
D.醋酸溶液与水垢中的 反应: 反应: |
您最近一年使用:0次
解题方法
4 . 利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程如下:
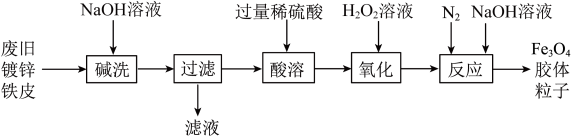
| A.Fe3O4俗称铁红 |
| B.“碱洗”的主要目的是除去镀锌铁皮表面的油污 |
| C.“酸溶”反应的离子方程式为Fe+2H+=Fe2++H2↑ |
D.“氧化”后溶液中所存在的离子为:H+、Fe3+、SO |
您最近一年使用:0次
解题方法
5 . 下列指定反应的离子方程式正确的是
A.碳酸氢钠和过量氢氧化钙反应:HCO +Ca2++OH-= CaCO3↓+H2O +Ca2++OH-= CaCO3↓+H2O |
B.用稀硝酸与铜反应:Cu+4H++ 2NO = Cu2++2NO2↑+2H2O = Cu2++2NO2↑+2H2O |
| C.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| D.H2SO4溶液与氨水反应:H++OH-=H2O |
您最近一年使用:0次
解题方法
6 . 下列曲线图与实验事实相一致的是
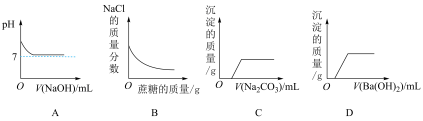

| A.向一定体积HCl溶液中滴加NaOH溶液 |
B. ,向一定量饱和NaCl溶液中不断加入蔗糖 ,向一定量饱和NaCl溶液中不断加入蔗糖 |
C.向一定量的HCl和 混合液中不断滴入 混合液中不断滴入 溶液 溶液 |
D.向HCl和 的混合液中加入过量 的混合液中加入过量 溶液 溶液 |
您最近一年使用:0次
7 . 下列各组物质加入水中充分搅拌后,同组反应物恰好完全反应,过滤后,在滤纸上留下两种不溶物质的是
A. | B. |
C. | D. |
您最近一年使用:0次
名校
解题方法
8 . 下列指定反应的离子方程式正确的是
A.大理石与盐酸反应: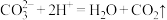 |
B. 使溴水褪色: 使溴水褪色: |
C.用 从酸化的海带灰浸出液中提取碘: 从酸化的海带灰浸出液中提取碘: |
D.铜片加入稀硝酸溶液中: |
您最近一年使用:0次
名校
9 . 锰元素能形成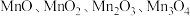 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为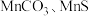 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知: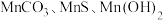 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢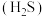 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
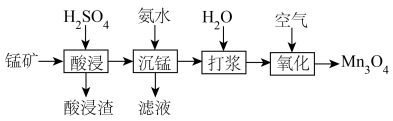
(1)“酸浸”: 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:___________ 。
(2)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
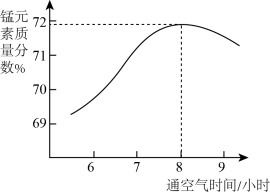
通空气超过8小时,产物中锰元素质量分数减小的原因是___________ 。
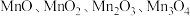 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为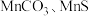 ),和软锰矿(主要成分为
),和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:
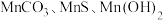 常温下皆为难溶于水的固体,硫化氢
常温下皆为难溶于水的固体,硫化氢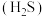 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
(1)“酸浸”:
 溶于硫酸的离子方程式:
溶于硫酸的离子方程式:(2)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(3)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。

通空气超过8小时,产物中锰元素质量分数减小的原因是
您最近一年使用:0次
名校
解题方法
10 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
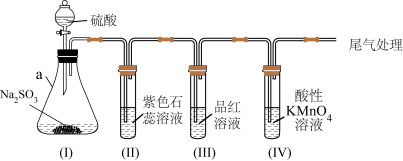
【实验探究】
(1)装置(I)仪器a的名称是___________ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为___________ ,写出相关的化学方程式___________ 。
②装置(III)中品红溶液________ ,原因是________ ,加热后,溶液又恢复_________ ,可用于检验SO2。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___________ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式___________ 。
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___________ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2___________ +4H+=3S↓+2H2O。
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和___________ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g∙kg-1 | 0.25g∙kg-1 | 1g∙kg-1 |
您最近一年使用:0次



