解题方法
1 . 化学正在走向精准。当代化学的三大支柱是:理论、实验和计算。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。______
Ⅱ.某硫铜矿的主要成分为 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):
步骤1:在1.00g试样中加入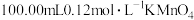 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用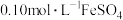 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数______ 。
Ⅰ.某溶液为硫酸和硝酸混合后的稀溶液,取200.00mL,该溶液加入过量锌粉充分反应。反应后溶液中只含有一种溶质,其浓度为
 (溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。
(溶液体积不变),收集到无色气体6.72L(标准状况),请列式计算溶液中硫酸和硝酸的浓度比,及产生的氢气的体积(标准状况)。Ⅱ.某硫铜矿的主要成分为
 ,可用于冶炼金属铜,为测定矿石中
,可用于冶炼金属铜,为测定矿石中 的质量分数,进行如下实验(杂质不参加反应):
的质量分数,进行如下实验(杂质不参加反应):步骤1:在1.00g试样中加入
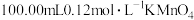 的酸性溶液,加热,硫元素全部转化为
的酸性溶液,加热,硫元素全部转化为 ,铜元素全部转化为
,铜元素全部转化为 ,滤去不溶性杂质。
,滤去不溶性杂质。步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用
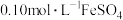 溶液与剩余
溶液与剩余 恰好反应,消耗10.00mL。列式计算
恰好反应,消耗10.00mL。列式计算 的质量分数
的质量分数
您最近一年使用:0次
2012·上海嘉定·二模
解题方法
2 . 硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图象处理行业。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为__ 。
(2)将32.64 g 铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2 L。其中NO的体积为__ 。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100 mL 0.6 mol HNO3溶液恰好使混合物完全溶解,同时收集到224 mL NO气体(S.T.P.)。则产物中硝酸铜的物质的量为_ 。如原混合物中有0.0l mol Cu,则其中Cu2O与CuO的质量比为__ 。
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,可产生标准状况下的气体多少升___ ?
(5)加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2 g,使之完全分解,得到固体残渣48.4 g。将反应后产生的气体通过水充分吸收后,剩余气体1.68 L(S.T.P.)。求原混合物中硝酸铜结晶水合物的化学式___ 。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3
 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为(2)将32.64 g 铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2 L。其中NO的体积为
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100 mL 0.6 mol HNO3溶液恰好使混合物完全溶解,同时收集到224 mL NO气体(S.T.P.)。则产物中硝酸铜的物质的量为
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,可产生标准状况下的气体多少升
(5)加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2 g,使之完全分解,得到固体残渣48.4 g。将反应后产生的气体通过水充分吸收后,剩余气体1.68 L(S.T.P.)。求原混合物中硝酸铜结晶水合物的化学式
您最近一年使用:0次
2014·上海杨浦·三模
3 . 氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是___ ;已知X的相对分子质量为153.5,则X的化学式为___ 。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2___ mol,气体的体积将变为___ mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数___ (保留4位有效数字)。
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量___ ;
②滤液中溶质的物质的量浓度___ 。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量
②滤液中溶质的物质的量浓度
您最近一年使用:0次
解题方法
4 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4。回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为___ 。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为___ 。
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少___ ?
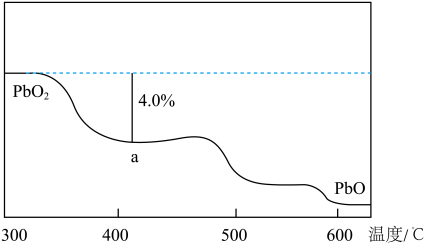
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值___ 、___ 。
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将amolPbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%【(即样品起始质量—a点固体质量)/样品起始质量×100%】的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值

您最近一年使用:0次
名校
5 . 黑火药是我国的四大发明之一,深受世人称赞,其反应原理为:S+3C+2KNO3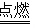 N2↑+3CO2↑+K2S请回答下列相关问题:
N2↑+3CO2↑+K2S请回答下列相关问题:
(1)当产生0.1molN2时,反应中共转移电子数为___________ ,还原剂的物质的量为___________ mol.
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是___________ mol.
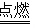 N2↑+3CO2↑+K2S请回答下列相关问题:
N2↑+3CO2↑+K2S请回答下列相关问题:(1)当产生0.1molN2时,反应中共转移电子数为
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是
您最近一年使用:0次
2017-02-28更新
|
937次组卷
|
2卷引用:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷
解题方法
6 . 天津港“8.12”特别重大爆炸事故教训深刻。氰化钠(N元素显﹣3价)属于剧毒化学品,处理氰化物的方法主要有两种:
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为: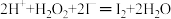 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为:
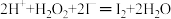 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
您最近一年使用:0次
7 . 将23.9 g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100 mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO,反应后溶液中H+的物质的量为0.160 mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4 g蓝色固体。
(1)铜片中单质铜的质量分数为__________。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)为_______。
(1)铜片中单质铜的质量分数为__________。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)为_______。
您最近一年使用:0次
13-14高三上·上海·期中
8 . 闪锌矿(主要成分为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是_________ 。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是________ 。
(3)若将ZnS溶于强酸可产生硫化氢气体。在120℃、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数_________ 。(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量________ 。
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是
(3)若将ZnS溶于强酸可产生硫化氢气体。在120℃、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量
您最近一年使用:0次
9 . 已知:Fe2+能被稀硝酸氧化,反应方程式:3Fe(NO3)2+ 4HNO3(稀) ="=" 3 Fe(NO3)3+ NO↑+ 2H2O
现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
(1)放出4480 mL气体时,消耗金属的质量为_______g
(2)稀硝酸的浓度为_______mol·L-1
(3)计算原混合物中铁和铜的物质的量比为
(4)加入400 mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为 。
现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
(1)放出4480 mL气体时,消耗金属的质量为_______g
(2)稀硝酸的浓度为_______mol·L-1
(3)计算原混合物中铁和铜的物质的量比为
(4)加入400 mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为 。
您最近一年使用:0次



