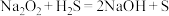1 . 下列对于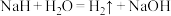 说法正确的是
说法正确的是
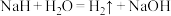 说法正确的是
说法正确的是| A.该反应属于置换反应 |
B.若该反应中有2mol电子转移,则生成 |
C.该条件下氧化性: |
D. 只是氧化产物 只是氧化产物 |
您最近一年使用:0次
2024-01-17更新
|
72次组卷
|
2卷引用:广东省广州天省实验学校2022-2023学年高一上学期期末考试化学试卷
名校
2 . 氧化还原反应在日常生活中有着广泛的应用,下列有关化学用语和相关说法均正确的是
选项 | 化学反应方程式 | 相关说法 |
A |
|  是氧化产物, 是氧化产物, 既是氧化剂又是还原剂 既是氧化剂又是还原剂 |
B |
| 均为单质被还原的置换反应 |
C |
| 每生成1mol |
D |
| 氧化性: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 实验小组探究 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。
已知:ⅰ. 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;
ⅱ.淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;
ⅲ. 与
与 发生反应:
发生反应: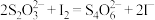
(1)实验1-1的目的是___________ ;
(2)实验1-2中 与KI反应的离子方程式为
与KI反应的离子方程式为___________ ;
为了探究 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
(3)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
猜想1: 先与
先与 反应,使
反应,使 降低;
降低;
猜想2: 先与KI反应,___________。
先与KI反应,___________。
①甲同学提出猜想1的依据:由信息ⅲ推测, 的还原性
的还原性___________ (填“强于”或“弱于”)KI的;
②乙同学根据现有数据证明猜想1不成立,理由是实验2-2与 完全反应后的溶液中
完全反应后的溶液中
___________ 2-1中起始 ,溶液应立即变蓝(填“高于”或“低于”);
,溶液应立即变蓝(填“高于”或“低于”);
③补全猜想2:___________ ;
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率
___________  (列出计算式);
(列出计算式);
(5)实验2-2中,30s内未检测到 与
与 反应,可能的原因是
反应,可能的原因是___________ (写出两条)。
 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。已知:ⅰ.
 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;ⅱ.淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;ⅲ.
 与
与 发生反应:
发生反应: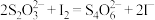
| 编号 | 1-1 | 1-2 |
| 实验操作 | 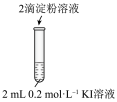 | 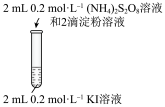 |
| 现象 | 无明显现象 | 溶液立即变蓝 |
(1)实验1-1的目的是
(2)实验1-2中
 与KI反应的离子方程式为
与KI反应的离子方程式为为了探究
 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表| 编号 |  KI溶液/mL KI溶液/mL |   溶液/mL 溶液/mL | 蒸馏水/mL | 0.4%淀粉溶液/滴 |   溶液/mL 溶液/mL | 变色时间/s |
| 2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
| 2-2 | 2 | 0.8 | 0.2 | 2 | 2 | 30 |
(3)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。猜想1:
 先与
先与 反应,使
反应,使 降低;
降低;猜想2:
 先与KI反应,___________。
先与KI反应,___________。①甲同学提出猜想1的依据:由信息ⅲ推测,
 的还原性
的还原性②乙同学根据现有数据证明猜想1不成立,理由是实验2-2与
 完全反应后的溶液中
完全反应后的溶液中
 ,溶液应立即变蓝(填“高于”或“低于”);
,溶液应立即变蓝(填“高于”或“低于”);③补全猜想2:
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率

 (列出计算式);
(列出计算式);(5)实验2-2中,30s内未检测到
 与
与 反应,可能的原因是
反应,可能的原因是
您最近一年使用:0次
名校
4 . 已知I-、Fe2+、SO2、Cl⁻和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-< H2O2 < Fe2+< I- <SO2,则下列反应不可能发生的是
| A.I2+SO2+2H2O =H2SO4+2HI | B.H2O2+H2SO4=SO2↑+O2↑ +2H2O |
| C.2Fe2++Cl₂=2Fe³⁺+2Cl⁻ | D.2Fe3++SO2+2H2O=2Fe2++SO +4H+ +4H+ |
您最近一年使用:0次
2023-10-14更新
|
17次组卷
|
2卷引用:陕西省咸阳市实验中学2022-2023学年高一上学期第二次月考化学试题
名校
解题方法
5 . 为研究Na的性质,进行如下实验:
下列说法错误的是
| 装置 | 实验 | |
| 液体a | 现象 | |
 | 蒸馏水 | I.Na浮在液面上,熔成小球,剧烈反应,产生少量白雾 |
| 稀盐酸 | II.Na浮在液面上,反应比I中剧烈,产生白雾 | |
| 硫酸铜溶液 | III.Na浮在液面上,剧烈反应,没有出现红色物质,烧杯中有蓝色沉淀 | |
| A.Ⅰ中现象说明Na与水反应放热 |
| B.Ⅱ中反应比I中剧烈是因为稀盐酸溶液中的H+浓度比蒸馏水中的H+浓度大很多 |
| C.Ⅲ中的蓝色沉淀可能是氢氧化铜 |
| D.Ⅲ中没有出现红色物质,说明没有铜单质生成,可据此判断Cu2+氧化性弱于H+ |
您最近一年使用:0次
2023-10-05更新
|
0次组卷
|
3卷引用:贵州省贵阳市清镇市第一中学2022-2023学年高一上学期期中考试化学试题
6 . 关于反应H2O+SO2+HClO=H2SO4(稀)+HCl,下列说法正确的是
| A.HClO发生氧化反应 |
| B.氧化性:HClO>H2SO4(稀) |
| C.参加反应的还原剂与氧化剂的质量之比为1∶1 |
| D.每生成2molHCl,转移2mol电子 |
您最近一年使用:0次
7 . 已知下列反应:①Cl2+2NaBr=2NaCl+Br2;②2KI+Br2=2KBr+I2;③Na2S+I2=2NaI+S↓。
(1)Cl-、Br-、I-、S2-四种离子的还原性由强到弱的顺序是_______ 。
(2)判断Cl2与Na2S能否反应?_______ (填“否”或书写反应的离子方程式)。
(3)判断I2与NaBr能否反应?_______ (填“否”或书写反应的离子方程式)。
(4)已知NH3和Cl2可以发生氧化还原反应,配平该方程式:_______ 。
_______NH3+_______Cl2=_______N2+_______HCl
(5)在硫酸溶液中,NaClO3和Na2SO3能按物质的量之比1∶2完全反应,生成一种棕黄色气体X,同时Na2SO3被氧化为Na2SO4,则X为_______。
(1)Cl-、Br-、I-、S2-四种离子的还原性由强到弱的顺序是
(2)判断Cl2与Na2S能否反应?
(3)判断I2与NaBr能否反应?
(4)已知NH3和Cl2可以发生氧化还原反应,配平该方程式:
_______NH3+_______Cl2=_______N2+_______HCl
(5)在硫酸溶液中,NaClO3和Na2SO3能按物质的量之比1∶2完全反应,生成一种棕黄色气体X,同时Na2SO3被氧化为Na2SO4,则X为_______。
| A.Cl2O7 | B.ClO2 | C.Cl2O | D.Cl2 |
您最近一年使用:0次
名校
8 . 黄铁矿的主要成分是FeS2 (Fe为 价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO
价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO +16H+。下列说法中正确的是
+16H+。下列说法中正确的是
 价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO
价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO +16H+。下列说法中正确的是
+16H+。下列说法中正确的是| A.反应中氧化产物和还原产物的物质的量之比为2∶15 |
| B.FeS2是反应中的氧化剂,发生还原反应 |
C.由反应可知氧化性:SO >Fe3+ >Fe3+ |
D.每生成1mol SO ,反应中转移的电子是7mol ,反应中转移的电子是7mol |
您最近一年使用:0次
2024-02-24更新
|
278次组卷
|
3卷引用:江苏省无锡市第一中学2022-2023学年高一上学期阶段性质量检测化学试题
9 . 取一定量的酸性硫酸锰( )溶液,向其中依次加入下列物质,对应现象如表所示:
)溶液,向其中依次加入下列物质,对应现象如表所示:
已知:
①金属铋(Bi)价态为+3时较稳定, 在水溶液中以离子形态存在;
在水溶液中以离子形态存在;
②铋酸钠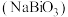 无色,难溶于水,高锰酸根离子呈紫红色;
无色,难溶于水,高锰酸根离子呈紫红色;
③淀粉溶液遇 变为蓝色。
变为蓝色。
(1)写出步骤1中的离子反应方程式______________ ,氧化产物为_____________ (填离子符号)。
(2)写出步骤2中的离子反应方程式________________________________ 。
(3)步骤2中过量的 可以氧化
可以氧化 ,则步骤3中现象A为
,则步骤3中现象A为________________________ 。
(4)由上述现象可知, 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为______________ 。
(5)根据上述结论,推断下列离子反应可能发生且书写正确的是__________ (填字母)。
a.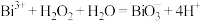
b.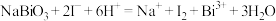
c.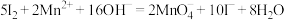
d.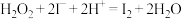
 )溶液,向其中依次加入下列物质,对应现象如表所示:
)溶液,向其中依次加入下列物质,对应现象如表所示:| 步骤1 | 步骤2 | 步骤3 | |
| 依次加入 | 适量 | 过量的 溶液 溶液 | 适量 -淀粉混合液 -淀粉混合液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 现象A |
①金属铋(Bi)价态为+3时较稳定,
 在水溶液中以离子形态存在;
在水溶液中以离子形态存在;②铋酸钠
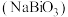 无色,难溶于水,高锰酸根离子呈紫红色;
无色,难溶于水,高锰酸根离子呈紫红色;③淀粉溶液遇
 变为蓝色。
变为蓝色。(1)写出步骤1中的离子反应方程式
(2)写出步骤2中的离子反应方程式
(3)步骤2中过量的
 可以氧化
可以氧化 ,则步骤3中现象A为
,则步骤3中现象A为(4)由上述现象可知,
 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(5)根据上述结论,推断下列离子反应可能发生且书写正确的是
a.
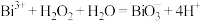
b.
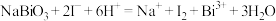
c.
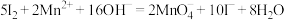
d.
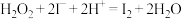
您最近一年使用:0次
名校
解题方法
10 . 下列实验操作、现象及结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向 、 、 混合溶液中依次加入少量氯水和 混合溶液中依次加入少量氯水和 ,振荡,静置 ,振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性: |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含 元素 元素 |
| C | 用 计测定 计测定 :① :① 溶液② 溶液② 溶液 溶液 |  :①>② :①>② |  酸性弱于 酸性弱于 |
| D | 向溶液中滴加盐酸酸化的 溶液 溶液 | 有白色沉淀生成 | 该溶液中不一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次


 ,
,
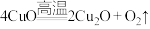
 个电子
个电子