名校
1 . i. 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
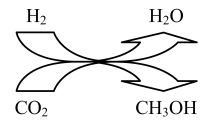
(1)利用 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为_______ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于_______ (填“电解质”或“非电解质”)。
②氨水吸收少量 ,可生成
,可生成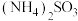 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
ii. 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
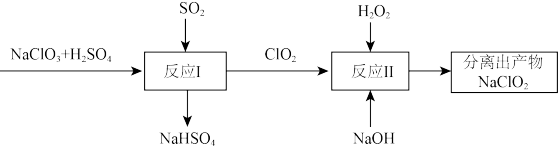
(4)反应I中氧化剂与还原剂的个数之比为_______ 。
(5)写出反应II的化学方程式_______ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的_______ 倍。(以单位质量得到的电子数表示,结果精确到0.01)
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于②氨水吸收少量
 ,可生成
,可生成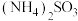 ,反应的离子方程式为
,反应的离子方程式为(3)所得溶液再用
 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为ii.
 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
(4)反应I中氧化剂与还原剂的个数之比为
(5)写出反应II的化学方程式
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的
您最近一年使用:0次
2022-10-12更新
|
528次组卷
|
3卷引用:江西省龙南中学2022-2023学年高一下学期4月期中考试化学试题
名校
2 . 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质。合成路线如下:(设NA为阿伏加德罗常数的值。)
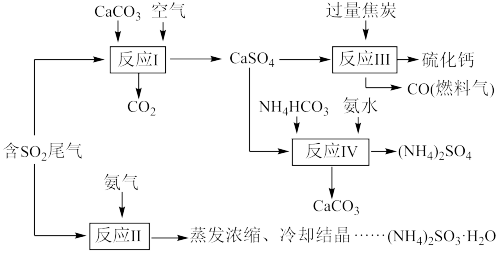
(1)写出反应I的化学方程式_______ 。
(2)反应Ⅲ中每生成1mol硫化钙理论上转移电子数为_______ ;为充分利用副产品CO,工业上常用CO与H2合成甲醇(CH3OH),已知1gCO完全反应生成甲醇气体时放出6.9kJ热量,请写出由CO与H2合成甲醇的热化学方程式:_______ 。
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有_______ 。
(4)根据合成流程,可以循环利用的是_______ 。
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵溶液反应的离子方程式_______ 。

(1)写出反应I的化学方程式
(2)反应Ⅲ中每生成1mol硫化钙理论上转移电子数为
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有
(4)根据合成流程,可以循环利用的是
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵溶液反应的离子方程式
您最近一年使用:0次
3 . 2022年3月,我国科学家在实验室实现 到淀粉的全合成,其合成路线如图:
到淀粉的全合成,其合成路线如图:
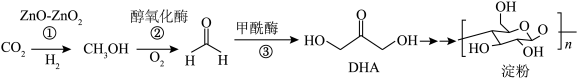
下列有关说法错误的是
 到淀粉的全合成,其合成路线如图:
到淀粉的全合成,其合成路线如图:
下列有关说法错误的是
A.反应②中,3.2 g  生成HCHO时转移电子数目为 生成HCHO时转移电子数目为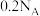 |
| B.为加快③反应速率,可采用高温环境进行反应 |
| C.DHA存在核磁共振只有一种氢的同分异构体 |
| D.1 mol DHA与乙酸发生取代反应,可消耗分子数目为NA的乙酸 |
您最近一年使用:0次
名校
解题方法
4 . 碳酸锰(MnCO3)是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质)制取碳酸锰的流程如图所示:

其中,还原焙烧主反应为2MnO2+C 2MnO+CO2↑。根据要求回答问题:
2MnO+CO2↑。根据要求回答问题:
(1)若在实验室中进行步骤A,则需用到的仪器为___________ 。步骤B中为了加快浸取的速率,可以采取的措施是___________ (填写两条即可)。
(2)步骤C中得到的滤渣的成分是___________ 。步骤D中氧化剂与还原剂的物质的量之比为___________ 。
(3)pH=0的溶液中,不同价态锰的微粒的能量(ΔG)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。

①MnO
___________ (填“能”或“不能”)稳定存在于pH=0的溶液中。
②将Mn3+歧化反应设计为原电池,可测定反应平衡常数。电池负极反应为___________
(4)步骤H的离子方程式为___________ 。实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全:2Mn2++5S2O +8H2O=16H++10SO
+8H2O=16H++10SO +2MnO
+2MnO ,确认Mn2+已完全反应的现象是
,确认Mn2+已完全反应的现象是___________ 。检验时必须控制Mn2+的浓度不能过大,否则实验失败。理由是___________ 。

其中,还原焙烧主反应为2MnO2+C
 2MnO+CO2↑。根据要求回答问题:
2MnO+CO2↑。根据要求回答问题:(1)若在实验室中进行步骤A,则需用到的仪器为
(2)步骤C中得到的滤渣的成分是
(3)pH=0的溶液中,不同价态锰的微粒的能量(ΔG)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。

①MnO

②将Mn3+歧化反应设计为原电池,可测定反应平衡常数。电池负极反应为
(4)步骤H的离子方程式为
 +8H2O=16H++10SO
+8H2O=16H++10SO +2MnO
+2MnO ,确认Mn2+已完全反应的现象是
,确认Mn2+已完全反应的现象是
您最近一年使用:0次
名校
解题方法
5 . 氮及其化合物在生产生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:

(1)实验室制备氨气有多种方法,现欲NH4Cl用与熟石灰反应制取NH3,则甲中的气体发生装置为______ 。(从Ⅱ中选用)
(2)装置丙用于收集NH3,应将导管_____ (填“a”或“b”)延长至集气瓶底部。
Ⅱ.由氨气为原料的合成硝酸工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决污染环境。
(3)臭氧脱硝法:O3氧化NO结合水洗,可产生HNO3,该反应的化学方程式为______ 。
(4)氨气催化吸收法处理尾气法:已知6mol氨气恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比______ 。
Ⅲ.NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(5)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-=2NO +H2O
+H2O
2NO2+2OH-=NO +NO
+NO +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有______ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是______ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是______ (填化学式)。
(6)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
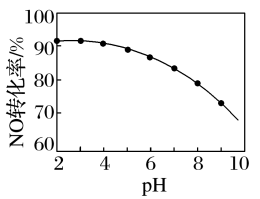
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO ,其离子方程式为
,其离子方程式为______ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是______ 。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:

(1)实验室制备氨气有多种方法,现欲NH4Cl用与熟石灰反应制取NH3,则甲中的气体发生装置为
(2)装置丙用于收集NH3,应将导管
Ⅱ.由氨气为原料的合成硝酸工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决污染环境。
(3)臭氧脱硝法:O3氧化NO结合水洗,可产生HNO3,该反应的化学方程式为
(4)氨气催化吸收法处理尾气法:已知6mol氨气恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比
Ⅲ.NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(5)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-=2NO
 +H2O
+H2O2NO2+2OH-=NO
 +NO
+NO +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(6)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近一年使用:0次
2023-03-09更新
|
604次组卷
|
3卷引用:江西省吉安市井冈山宁冈中学2022-2023学年高一下学期5月期中考试化学试题
名校
解题方法
6 . 钯(Pd)是重要的金属元素,在有机合成工业上用途广泛。自然界中,钯含量少,常伴生在其他矿藏中,如硫化镍铜矿、镍黄铁矿等。以硫化镍铜矿(含有CuS、NiS、 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:

已知“酸浸”后的固体剩余物为 、PdO(不与碱反应)。
、PdO(不与碱反应)。
回答下列问题:
(1)“灼烧”时产生的污染性气体是_______ (填化学式)。
(2)写出“除硅”反应的离子方程式:_______ 。
(3)“还原”时反应还生成无污染的气体,化学方程式为_______ 。
(4)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有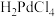 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:_______ 。
(5)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
(6)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=_______ 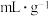 ,氢气的浓度r=
,氢气的浓度r=_______ (结果保留两位小数)。(吸附容量R即1g钯吸附氢气的体积;氢气的浓度r为1mol Pd吸附氢气的物质的量)
 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:
已知“酸浸”后的固体剩余物为
 、PdO(不与碱反应)。
、PdO(不与碱反应)。回答下列问题:
(1)“灼烧”时产生的污染性气体是
(2)写出“除硅”反应的离子方程式:
(3)“还原”时反应还生成无污染的气体,化学方程式为
(4)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有
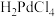 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:(5)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为
(6)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=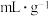 ,氢气的浓度r=
,氢气的浓度r=
您最近一年使用:0次
名校
7 . 钯(Pd)是重要的金属元素,在有机合成工业上用途广泛。自然界中,钯含量少,常伴生在其他矿藏中,如硫化镍铜矿、镍黄铁矿等。以硫化镍铜矿(含有CuS、NiS、 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:

已知“酸浸”后的固体剩余物为 、PdO(不与碱反应)。
、PdO(不与碱反应)。
回答下列问题:
(1)“灼烧”时产生的污染性气体是_______ (填化学式)。
(2)写出“除硅”反应的离子方程式:_______ 。
(3)“系列操作”包括_______ ,过滤、洗涤、干燥。
(4)“还原”时反应还生成无污染的气体,化学方程式为_______ 。
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有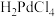 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:_______ 。
(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
(7)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=_______ 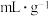 ,氢气的浓度r=
,氢气的浓度r=_______ (结果保留两位小数)。(吸附容量R即1g钯吸附氢气的体积;氢气的浓度r为1mol Pd吸附氢气的物质的量)
 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:
已知“酸浸”后的固体剩余物为
 、PdO(不与碱反应)。
、PdO(不与碱反应)。回答下列问题:
(1)“灼烧”时产生的污染性气体是
(2)写出“除硅”反应的离子方程式:
(3)“系列操作”包括
(4)“还原”时反应还生成无污染的气体,化学方程式为
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有
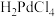 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为
(7)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=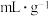 ,氢气的浓度r=
,氢气的浓度r=
您最近一年使用:0次
2022-10-01更新
|
342次组卷
|
3卷引用:江西九师联盟2023届高三9月联考化学试题
20-21高三上·江西·阶段练习
解题方法
8 . 碲化钠(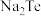 )可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为
)可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为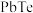 )和粗盐(含
)和粗盐(含 、
、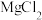 及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下。
及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下。
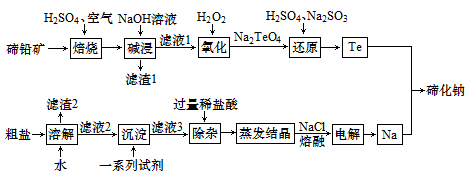
(1)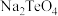 中Te的化合价为
中Te的化合价为________ 。
(2)铅的质子数为82,则铅在元素周期表中的位置是________ 。
(3)“蒸发结晶”时,用到的仪器有________ 、________ 、酒精灯、铁架台。
(4)“焙烧”后,碲主要以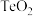 的形式存在,写出“焙烧”时反应的化学方程式
的形式存在,写出“焙烧”时反应的化学方程式________________ 。
(5)根据“氧化”和“还原”两步反应, 、
、 、
、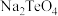 的氧化性由弱到强的顺序为
的氧化性由弱到强的顺序为________ ,“还原”步骤中还原剂与氧化剂的物质的量之比为________ 。
(6)若制得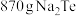 ,理论上“电解”产生
,理论上“电解”产生 的体积为
的体积为________ (标准状况下)。
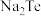 )可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为
)可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为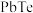 )和粗盐(含
)和粗盐(含 、
、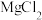 及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下。
及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下。
(1)
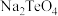 中Te的化合价为
中Te的化合价为(2)铅的质子数为82,则铅在元素周期表中的位置是
(3)“蒸发结晶”时,用到的仪器有
(4)“焙烧”后,碲主要以
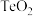 的形式存在,写出“焙烧”时反应的化学方程式
的形式存在,写出“焙烧”时反应的化学方程式(5)根据“氧化”和“还原”两步反应,
 、
、 、
、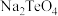 的氧化性由弱到强的顺序为
的氧化性由弱到强的顺序为(6)若制得
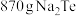 ,理论上“电解”产生
,理论上“电解”产生 的体积为
的体积为
您最近一年使用:0次
名校
解题方法
9 . (1)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
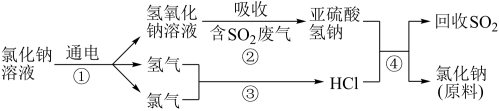
写出反应②的化学方程式_____ 。
(2)亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”的物质(该物质对人体有害),其结构简式为HOCH2SO3Na,根据其结构特点,可判断“吊白块”能发生的反应有_____ 。
A.皂化反应 B.加聚反应 C.与金属钠反应 D.氧化反应
(3)近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油(用C5H12表示),试写出该反应的化学方程式____ 。
(4)煤的气化和液化属于_____ (填“物理”或“化学”)变化。
(5)可燃冰属于新能源,我国是全球第一个成功稳定开采可燃冰的国家。某种可燃冰(甲烷水合物)晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或1个水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,则这种可燃冰的平均组成可表示为__ 。
(6)海水中溴含量为65mg·L-1。若1L 海水中有95%的溴元素被氧化为Br2。经热空气吹出,溴单质残留量为3%。最后用SO2将90%的Br2 还原成Br-,所得溶液体积为50mL,则所得溶液中溴离子浓度为原海水中溴离子浓度的___ 倍(计算结果精确到0.1)。

写出反应②的化学方程式
(2)亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”的物质(该物质对人体有害),其结构简式为HOCH2SO3Na,根据其结构特点,可判断“吊白块”能发生的反应有
A.皂化反应 B.加聚反应 C.与金属钠反应 D.氧化反应
(3)近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油(用C5H12表示),试写出该反应的化学方程式
(4)煤的气化和液化属于
(5)可燃冰属于新能源,我国是全球第一个成功稳定开采可燃冰的国家。某种可燃冰(甲烷水合物)晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或1个水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,则这种可燃冰的平均组成可表示为
(6)海水中溴含量为65mg·L-1。若1L 海水中有95%的溴元素被氧化为Br2。经热空气吹出,溴单质残留量为3%。最后用SO2将90%的Br2 还原成Br-,所得溶液体积为50mL,则所得溶液中溴离子浓度为原海水中溴离子浓度的
您最近一年使用:0次
10 . 硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气: N2(g)+3H2(g) ⇌2NH3(g) △H<0,一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的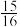 ,则N2的转化率a1=
,则N2的转化率a1=_______ ;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______ a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸:
①NH3被氧气催化氧化生成NO的反应的化学方程式是___________________________________ ;
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)⇌2NO2(g)△H>0 该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_______________ ;

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2(g)⇌N2O4(g) △H<0,恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1、a2,已知T1<T2,则a1_______ a2
(3)硝酸厂常用如下2种方法处理尾气:
①催化还原法:催化剂存在时用H2将NO2还原为N2;
已知:2H2(g)+O2(g)=2H2O(g) △H=﹣483.5kJ/mol 、N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_________________________ ;
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2,若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是__________________________________ 。
(1)以N2和H2为原料合成氨气: N2(g)+3H2(g) ⇌2NH3(g) △H<0,一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的
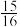 ,则N2的转化率a1=
,则N2的转化率a1=(2)以氨气、空气为主要原料制硝酸:
①NH3被氧气催化氧化生成NO的反应的化学方程式是
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)⇌2NO2(g)△H>0 该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2(g)⇌N2O4(g) △H<0,恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1、a2,已知T1<T2,则a1
| A.大于 | B.小于 | C.等于 | D.以上都有可能 |
(3)硝酸厂常用如下2种方法处理尾气:
①催化还原法:催化剂存在时用H2将NO2还原为N2;
已知:2H2(g)+O2(g)=2H2O(g) △H=﹣483.5kJ/mol 、N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2,若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
您最近一年使用:0次



