名校
解题方法
1 . 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
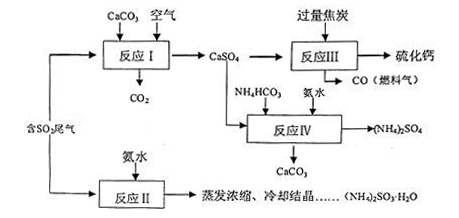
(1)写出反应Ⅰ的化学方程式________________________ .
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________ ;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________ .
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________ .
(4)根据合成流程,可以循环利用的是____________ .
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________ .

(1)写出反应Ⅰ的化学方程式
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有
(4)根据合成流程,可以循环利用的是
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式
您最近一年使用:0次
2017-02-28更新
|
302次组卷
|
4卷引用:河南省南阳市2020届高三上学期期中质量评估化学试题
河南省南阳市2020届高三上学期期中质量评估化学试题(已下线)专题七 工艺流程题(提分特训)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训陕西省西安市第一中学2021届高三上学期第五次模拟考试化学试题2016-2017学年辽宁省六校协作体高二下学期期初化学试卷
名校
2 . 纳米氧化亚铜(Cu2O,颗粒直径1~100nm)具有特殊的光学、光电和催化性能,采用化学沉淀法制备晶型结构完整、粒度分布均匀的纳米Cu2O(在潮湿空气中会慢慢氧化生成CuO)的合成路线如图所示。下列说法正确的是
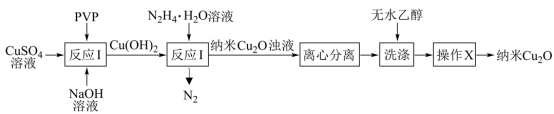

| A.反应Ⅰ为化合反应 |
| B.操作X为过滤 |
| C.反应Ⅱ中,每生成22.4L(标准状况)N2,转移4mol电子 |
| D.“洗涤”时,无水乙醇可用蒸馏水代替 |
您最近一年使用:0次
2021-10-09更新
|
412次组卷
|
3卷引用:河南省陈州高级中学2022届高三上学期10月月考化学试题
名校
3 . 氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
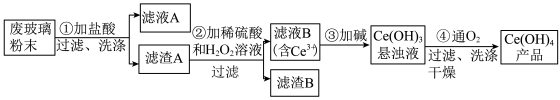
下列说法错误的是

下列说法错误的是
| A.滤渣A中主要含有SiO2、CeO2 |
| B.过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒 |
| C.过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑ |
| D.过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023 |
您最近一年使用:0次
2019-05-31更新
|
1861次组卷
|
12卷引用:河南省商丘市第一高级中学2021-2022学年高一上学期期末考试化学试题
河南省商丘市第一高级中学2021-2022学年高一上学期期末考试化学试题河南省南阳市2021-2022学年高一下学期期终质量评估化学试题 【市级联考】福建省福州市2019届高三第三次质量检测理科综合化学试题专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)【新东方】 2020-17四川省成都市实验中学2020届高考化学模拟试卷(二)陕西省安康中学2023届高三第一次检测性考试化学试题湖北省麻城市实验高级中学2021-2022学年高三下学期第一次联考化学试题天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题08 元素及其化合物(测)-2023年高考化学二轮复习讲练测(新高考专用)山东省滕州市第一中学2022-2023学年高一下学期6月月考化学试题天津市第四十七中学2023-2024学年高三上学期第一次阶段性检测化学试题
名校
4 . 钯(Pd)是重要的金属元素,在有机合成工业上用途广泛。自然界中,钯含量少,常伴生在其他矿藏中,如硫化镍铜矿、镍黄铁矿等。以硫化镍铜矿(含有CuS、NiS、 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:

已知“酸浸”后的固体剩余物为 、PdO(不与碱反应)。
、PdO(不与碱反应)。
回答下列问题:
(1)“灼烧”时产生的污染性气体是_______ (填化学式)。
(2)写出“除硅”反应的离子方程式:_______ 。
(3)“系列操作”包括_______ ,过滤、洗涤、干燥。
(4)“还原”时反应还生成无污染的气体,化学方程式为_______ 。
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:_______ 。
(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
(7)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=_______ 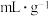 ,氢气的浓度r=
,氢气的浓度r=_______ (结果保留两位小数)。(吸附容量R即1g钯吸附氢气的体积;氢气的浓度r为1mol Pd吸附氢气的物质的量)
 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:
已知“酸浸”后的固体剩余物为
 、PdO(不与碱反应)。
、PdO(不与碱反应)。回答下列问题:
(1)“灼烧”时产生的污染性气体是
(2)写出“除硅”反应的离子方程式:
(3)“系列操作”包括
(4)“还原”时反应还生成无污染的气体,化学方程式为
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有
 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为
(7)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=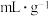 ,氢气的浓度r=
,氢气的浓度r=
您最近一年使用:0次
2022-10-01更新
|
342次组卷
|
3卷引用:河南省洛阳市2022-2023学年高三上学期9月联考化学试题
5 . 硫、氮的氧化物是大气的主要污染物,汽车尾气、工业废气、烟道气等均含有硫或氮元素的氧化物,以 和
和 为主要存在形式。回答下列问题:
为主要存在形式。回答下列问题:
(1)下列关于 和
和 的叙述中正确的是_______(填字母)。
的叙述中正确的是_______(填字母)。
(2) 溶液可以吸收
溶液可以吸收 和
和 ,将
,将 与
与 的混合气体持续通入一定量的
的混合气体持续通入一定量的 溶液中,产物中某离子X的物质的量浓度
溶液中,产物中某离子X的物质的量浓度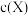 与通入气体的体积有如图所示关系,该离子是
与通入气体的体积有如图所示关系,该离子是_______ 。

(3)已知: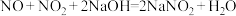 ;
;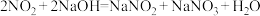 。以
。以 溶液和
溶液和 气体为原料,相互反应可得到硫酸溶液及
气体为原料,相互反应可得到硫酸溶液及 与
与 的混合气体,再将所得混合气体通入
的混合气体,再将所得混合气体通入 溶液可生产
溶液可生产 。若得到的盐全部为
。若得到的盐全部为 ,则原料
,则原料 和
和 的物质的量之比为
的物质的量之比为_______ 。
(4)化石燃料燃烧的烟气中含有影响环境的氮、硫氧化物,因此要对烟气进行脱硝、脱硫处理。研究表明: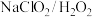 酸性复合吸收剂可同时有效脱硫、脱硝。如图所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
酸性复合吸收剂可同时有效脱硫、脱硝。如图所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
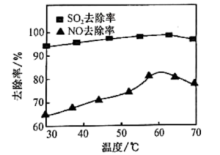
①温度高, 去除率随温度升高而下降的原因为
去除率随温度升高而下降的原因为_______ 。
②写出废气中的 与
与 反应的离子方程式:
反应的离子方程式:_______ 。
(5)烟道气中含有 ,采用如下的方法来测定
,采用如下的方法来测定 的含量:将
的含量:将 气样通入适量酸化的
气样通入适量酸化的 溶液中,使
溶液中,使 完全被氧化为
完全被氧化为 ,加水稀释至
,加水稀释至 。量取
。量取 该溶液,加入
该溶液,加入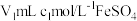 标准溶液(过量),充分反应后,用
标准溶液(过量),充分反应后,用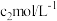 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 ,终点时消耗
,终点时消耗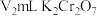 标准溶液。
标准溶液。
① 被
被 氧化为
氧化为 的离子方程式是
的离子方程式是_______ 。
②滴定过程中发生下列反应:
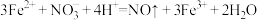 ;
;
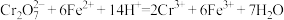 。
。
则气样中 折合成
折合成 的含量为
的含量为_______ 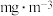 。
。
 和
和 为主要存在形式。回答下列问题:
为主要存在形式。回答下列问题:(1)下列关于
 和
和 的叙述中正确的是_______(填字母)。
的叙述中正确的是_______(填字母)。| A.两种气体都无色有毒,且都可用水吸收以消除对空气的污染 |
B.实验室制备 、 、 时,均可用向上排空气的方法收集 时,均可用向上排空气的方法收集 |
| C.两种气体都具有强氧化性,因此都能够使品红溶液褪色 |
D. 与 与 反应转化为 反应转化为 ,属于氮的固定 ,属于氮的固定 |
 溶液可以吸收
溶液可以吸收 和
和 ,将
,将 与
与 的混合气体持续通入一定量的
的混合气体持续通入一定量的 溶液中,产物中某离子X的物质的量浓度
溶液中,产物中某离子X的物质的量浓度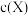 与通入气体的体积有如图所示关系,该离子是
与通入气体的体积有如图所示关系,该离子是
(3)已知:
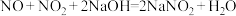 ;
;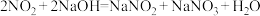 。以
。以 溶液和
溶液和 气体为原料,相互反应可得到硫酸溶液及
气体为原料,相互反应可得到硫酸溶液及 与
与 的混合气体,再将所得混合气体通入
的混合气体,再将所得混合气体通入 溶液可生产
溶液可生产 。若得到的盐全部为
。若得到的盐全部为 ,则原料
,则原料 和
和 的物质的量之比为
的物质的量之比为(4)化石燃料燃烧的烟气中含有影响环境的氮、硫氧化物,因此要对烟气进行脱硝、脱硫处理。研究表明:
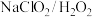 酸性复合吸收剂可同时有效脱硫、脱硝。如图所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
酸性复合吸收剂可同时有效脱硫、脱硝。如图所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
①温度高,
 去除率随温度升高而下降的原因为
去除率随温度升高而下降的原因为②写出废气中的
 与
与 反应的离子方程式:
反应的离子方程式:(5)烟道气中含有
 ,采用如下的方法来测定
,采用如下的方法来测定 的含量:将
的含量:将 气样通入适量酸化的
气样通入适量酸化的 溶液中,使
溶液中,使 完全被氧化为
完全被氧化为 ,加水稀释至
,加水稀释至 。量取
。量取 该溶液,加入
该溶液,加入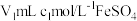 标准溶液(过量),充分反应后,用
标准溶液(过量),充分反应后,用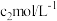 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 ,终点时消耗
,终点时消耗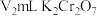 标准溶液。
标准溶液。①
 被
被 氧化为
氧化为 的离子方程式是
的离子方程式是②滴定过程中发生下列反应:
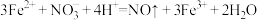 ;
;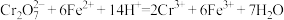 。
。则气样中
 折合成
折合成 的含量为
的含量为 。
。
您最近一年使用:0次
2021-11-02更新
|
274次组卷
|
2卷引用:河南省部分名校2021-2022学年高三上学期10月质量检测化学试题
名校
解题方法
6 . 氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为_______ 。
(2)反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) 在合成塔中进行。图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A. 0.6~0.7;B. 1~1.1;C. 1.5~1.61。生产中应选用水碳比的数值为_______ (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是_______ 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=_______ (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_______ %。

(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式_______ 。生产中可分离出的物质A的化学式为_______ 。

(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为
(2)反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) 在合成塔中进行。图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A. 0.6~0.7;B. 1~1.1;C. 1.5~1.61。生产中应选用水碳比的数值为
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为

(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式

您最近一年使用:0次
2016-12-09更新
|
356次组卷
|
6卷引用:2016-2017学年河南省郑州一中高二上期中化学卷



