名校
解题方法
1 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。结合下列有关图示和所学知识回答:
(1)①科学家提出由 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。

已知“重整系统”发生的反应中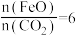 ,则
,则 的化学式为
的化学式为___________ 。“热分解系统”中每分解 ,转移电子的物质的量为
,转移电子的物质的量为___________ mol。
②工业上用 和
和 反应合成二甲醚。
反应合成二甲醚。
已知:
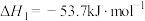 ,
,

 ,
,
则用 和
和 反应合成二甲醚的热化学反应方程式为
反应合成二甲醚的热化学反应方程式为___________ 。
(2)在一个容积可变的密闭容器中发生反应: ,其平衡常数(K)和温度(t)的关系如下表所示:
,其平衡常数(K)和温度(t)的关系如下表所示:
①反应的平衡常数表达式为
___________ ;该反应为___________ 反应(填“吸热”或“放热”)。
②在830℃时,向容器中充入1molCO、 ,保持温度不变,反应达到平衡后,其平衡常数
,保持温度不变,反应达到平衡后,其平衡常数___________ 1.0(填“大于”、“小于”或“等于”)。
③若1200℃时,在某时刻反应混合物中 、
、 、CO、
、CO、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时上述反应的平衡移动方向为
,则此时上述反应的平衡移动方向为___________ (填“正反应方向”、“逆反应方向”或“不移动”。)
(3)科学家以二氧化碳为原料,开发新型电池。可以利用如图装置,“溶解”水中的二氧化碳,生成电能和氢气,请写出二氧化碳生成氢气的电极反应式___________ 。

(1)①科学家提出由
 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
已知“重整系统”发生的反应中
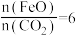 ,则
,则 的化学式为
的化学式为 ,转移电子的物质的量为
,转移电子的物质的量为②工业上用
 和
和 反应合成二甲醚。
反应合成二甲醚。已知:

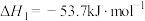 ,
,
 ,
,则用
 和
和 反应合成二甲醚的热化学反应方程式为
反应合成二甲醚的热化学反应方程式为(2)在一个容积可变的密闭容器中发生反应:
 ,其平衡常数(K)和温度(t)的关系如下表所示:
,其平衡常数(K)和温度(t)的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

②在830℃时,向容器中充入1molCO、
 ,保持温度不变,反应达到平衡后,其平衡常数
,保持温度不变,反应达到平衡后,其平衡常数③若1200℃时,在某时刻反应混合物中
 、
、 、CO、
、CO、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时上述反应的平衡移动方向为
,则此时上述反应的平衡移动方向为(3)科学家以二氧化碳为原料,开发新型电池。可以利用如图装置,“溶解”水中的二氧化碳,生成电能和氢气,请写出二氧化碳生成氢气的电极反应式

您最近一年使用:0次
解题方法
2 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料工业上可由天然二氧化锰粉与硫化锰矿(主要成分为 ,还含
,还含 等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
等元素的氧化物)制备,工艺流程如图所示。回答下列问题:

相关金属离子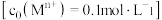 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:
(1)已知“溶浸”中发生反应的化学方程式为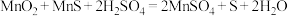 ,当生成
,当生成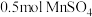 时,该反应中转移
时,该反应中转移___________  电子,该反应中n(还原剂):n(氧化剂)=
电子,该反应中n(还原剂):n(氧化剂)=___________ ,“滤渣1”的主要成分为___________ (填化学式)
(2)“氧化”中添加适量的 的作用是将
的作用是将 氧化为
氧化为 ,酸性条件下
,酸性条件下 氧化
氧化 反应的离子方程式为
反应的离子方程式为___________ (已知: 被还原为
被还原为 )。
)。
(3)“除杂1”的目的是除去 和
和 ,“除杂2”的目的是将
,“除杂2”的目的是将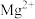 转化为
转化为 沉淀从而除去
沉淀从而除去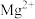 ﹐试推测“调
﹐试推测“调 ”是为了除
”是为了除___________ (填元素符号),溶液的 范围应调节在
范围应调节在___________ ~6(当某金属离子沉淀完全视作该金属离子已除净)。
(4)写出“沉锰”时发生反应的离子方程式:___________ 。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为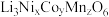 ,其中
,其中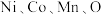 的化合价依次为
的化合价依次为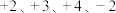 。当
。当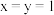 时,
时,
___________ ,试用氧化物的形式表示镍钴锰三元材料:___________ [某些含氧酸盐可以写成氧化物的形式(例如: 可以表示为
可以表示为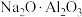 )]。
)]。
 ,还含
,还含 等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
等元素的氧化物)制备,工艺流程如图所示。回答下列问题:
相关金属离子
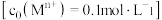 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表:
范围如下表:| 金属离子 |  |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
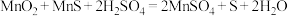 ,当生成
,当生成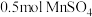 时,该反应中转移
时,该反应中转移 电子,该反应中n(还原剂):n(氧化剂)=
电子,该反应中n(还原剂):n(氧化剂)=(2)“氧化”中添加适量的
 的作用是将
的作用是将 氧化为
氧化为 ,酸性条件下
,酸性条件下 氧化
氧化 反应的离子方程式为
反应的离子方程式为 被还原为
被还原为 )。
)。(3)“除杂1”的目的是除去
 和
和 ,“除杂2”的目的是将
,“除杂2”的目的是将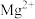 转化为
转化为 沉淀从而除去
沉淀从而除去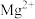 ﹐试推测“调
﹐试推测“调 ”是为了除
”是为了除 范围应调节在
范围应调节在(4)写出“沉锰”时发生反应的离子方程式:
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为
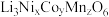 ,其中
,其中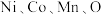 的化合价依次为
的化合价依次为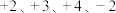 。当
。当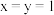 时,
时,
 可以表示为
可以表示为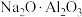 )]。
)]。
您最近一年使用:0次
2023-07-04更新
|
133次组卷
|
2卷引用:河北省保定市2022~2023学年高一下学期期末调研考试化学试题
名校
解题方法
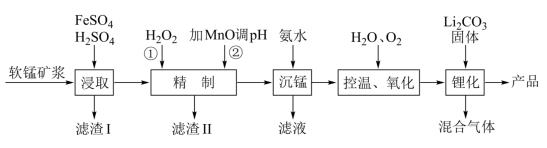
3 . 锰酸锂离子蓄电池是第二代锂离子动力电池,性能优良。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂(LiMn2O4)。流程如图:
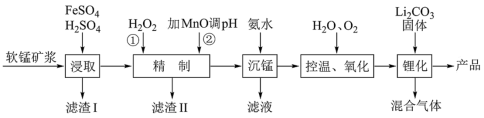
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为______ 。
(2)滤渣II的主要成分是______ ;“精制”中加入H2O2的量比理论值大得多,其主要原因是_____ 。
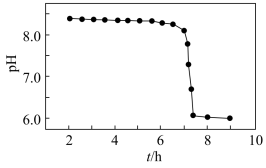
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是______ (用化学方程式表示)。
(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为______ 。
(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是_____ 。
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy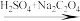 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为______ 。

(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为
(2)滤渣II的主要成分是
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为
 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy
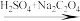 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
您最近一年使用:0次
2023-01-10更新
|
598次组卷
|
3卷引用:河北省部分学校2023届高三下学期二模联考化学试题
解题方法
4 . 锰酸锂离子蓄电池是第二代锂离子动力电池,性能优良。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂(LiMn2O4)。流程如图:
已知:Ksp[Fe(OH)3]=2.6×10-39,,Ksp[Mn(OH)2]=1.6×10-13,Ksp[Fe(OH)2]=4.9×10-17,Ksp[Al(OH)3]=1.0×10-33,lg2≈0.3
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_______ 。
(2)“精制”中加入H2O2的量比理论值大得多,其主要原因是______ ;若Mn2+的浓度为1.0mol•L-1,则加MnO调节pH的范围为_______ (离子浓度≤1.0×10-6mol•L-1时,可认为沉淀完全)。
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是_______ (用化学方程式表示)。

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2,K2S2O8中S元素的化合价为_______ ;此反应的氧化剂和还原剂的物质的量之比为________ 。
(5)“锂化”是将MnO2和Li2CO3按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。写出反应的化学方程式_______ 。

已知:Ksp[Fe(OH)3]=2.6×10-39,,Ksp[Mn(OH)2]=1.6×10-13,Ksp[Fe(OH)2]=4.9×10-17,Ksp[Al(OH)3]=1.0×10-33,lg2≈0.3
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为
(2)“精制”中加入H2O2的量比理论值大得多,其主要原因是
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2,K2S2O8中S元素的化合价为
(5)“锂化”是将MnO2和Li2CO3按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。写出反应的化学方程式
您最近一年使用:0次
名校
5 . 氮肥的使用极大提高了粮食作物的产量,对解决世界粮食危机起到了不可或缺的作用,下面是几种通过氮的固定制备氮肥的方法。
(1)自然固氮:一种途径是通过雷电将空气中少量的氮气转化为含氮化合物(氮肥),主要转化途径如下(转化所需试剂及条件已略去):
 硝酸盐[如
硝酸盐[如 ]
]
①写出在空气中 转化为NO的化学方程式
转化为NO的化学方程式_______ 。
②将 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M_______ (写化学式)。
③若M是Cu单质,与稀硝酸反应也能生成硝酸盐,写出铜粉与稀硝酸反应的离子方程式_______ 。
(2)人工固氮:
①工业上以氮气和氢气为原料,在高温、高压和催化剂的条件下合成氨。该反应的化学方程式为_______ 。
②利用氨气与氧气在催化剂作用下生成NO,是工业制备硝酸的重要环节,该反应中NO是_______ (填“氧化产物”“还原产物”或“氧化产物和还原产物”)。
③利用氨气与二氧化碳在催化剂作用下合成重要氮肥尿素 ,尿素中N元素的化合价是
,尿素中N元素的化合价是_______ 。合成尿素的化学方程式_______ 。尿素在土壤中与水结合生成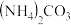 ,被植物吸收,有利于作物的生长。
,被植物吸收,有利于作物的生长。
(3)在微生物作用下实现 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为_______ 。由于 有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
(4)有同学猜测,在 被细菌分解过程中,
被细菌分解过程中, 最终分解为
最终分解为 ,同时有
,同时有 生成。从化合价变化的角度分析有
生成。从化合价变化的角度分析有 生成的合理性
生成的合理性_______ 。
(1)自然固氮:一种途径是通过雷电将空气中少量的氮气转化为含氮化合物(氮肥),主要转化途径如下(转化所需试剂及条件已略去):
 硝酸盐[如
硝酸盐[如 ]
]①写出在空气中
 转化为NO的化学方程式
转化为NO的化学方程式②将
 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M③若M是Cu单质,与稀硝酸反应也能生成硝酸盐,写出铜粉与稀硝酸反应的离子方程式
(2)人工固氮:
①工业上以氮气和氢气为原料,在高温、高压和催化剂的条件下合成氨。该反应的化学方程式为
②利用氨气与氧气在催化剂作用下生成NO,是工业制备硝酸的重要环节,该反应中NO是
③利用氨气与二氧化碳在催化剂作用下合成重要氮肥尿素
 ,尿素中N元素的化合价是
,尿素中N元素的化合价是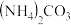 ,被植物吸收,有利于作物的生长。
,被植物吸收,有利于作物的生长。(3)在微生物作用下实现
 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为 有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。(4)有同学猜测,在
 被细菌分解过程中,
被细菌分解过程中, 最终分解为
最终分解为 ,同时有
,同时有 生成。从化合价变化的角度分析有
生成。从化合价变化的角度分析有 生成的合理性
生成的合理性
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.含氨废水和废气对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4 mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:_____ NO3-+_______ Al+_______ H2O→_______ N2↑+______ Al(OH)3+________ OH-。
(2)上述反应中被还原的元素是____________ ,每生成2 mol N2转移_________ mol电子。
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为_________ g。
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5 ℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:
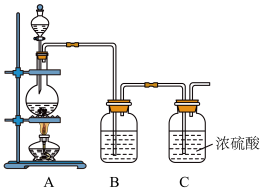
(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_________________________ 。
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①装置D中发生的反应方程式为__________________________ 。
②如果不用装置E会引起什么后果:__________________ 。
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____________ ,为了充分吸收尾气,可将尾气与________________ 同时通入氢氧化钠溶液中。
(1)配平下列有关离子方程式:
(2)上述反应中被还原的元素是
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5 ℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:

(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①装置D中发生的反应方程式为
②如果不用装置E会引起什么后果:
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为
您最近一年使用:0次
名校
解题方法
7 . 氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为_______ 。
(2)反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) 在合成塔中进行。图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A. 0.6~0.7;B. 1~1.1;C. 1.5~1.61。生产中应选用水碳比的数值为_______ (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是_______ 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=_______ (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_______ %。

(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式_______ 。生产中可分离出的物质A的化学式为_______ 。

(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为
(2)反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) 在合成塔中进行。图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A. 0.6~0.7;B. 1~1.1;C. 1.5~1.61。生产中应选用水碳比的数值为
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为

(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式

您最近一年使用:0次
2016-12-09更新
|
356次组卷
|
6卷引用:2017届河北省衡水中学高三上期中化学卷



