1 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以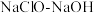 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(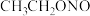 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以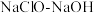 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(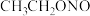 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入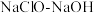 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成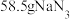 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生___________ 反应,说明亚硝酸钠具有___________ 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有___________ 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是___________ ,还原剂是___________ ,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为___________ 。
(3)近年来,锂的含氢化合物作为氢源受到广泛关注。化合物LiNH2和LiH都是具有潜在应用价值的释氢材料。将LiNH2和LiH按一定比例混合,在催化剂作用下,所含氢全部以氢气形式放出同时生成Li3N,反应的化学方程式为___________ 。
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是
(3)近年来,锂的含氢化合物作为氢源受到广泛关注。化合物LiNH2和LiH都是具有潜在应用价值的释氢材料。将LiNH2和LiH按一定比例混合,在催化剂作用下,所含氢全部以氢气形式放出同时生成Li3N,反应的化学方程式为
您最近一年使用:0次
名校
3 . 二氧化铈(CeO2)是重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+ 能被萃取剂 TBP 萃取,而Ce3+ 不能。回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是___________ 。
(2)氧化焙烧后的固体产物中含有 CeO2和 CeF4物质的量之比为 3:1,“酸浸”时发生反应的离子方程式为___________ 。传统工艺中用盐酸替代硫酸,其缺点为___________ 。
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP CeTBP4++F-,氟洗液中添加 Al3+的作用是
CeTBP4++F-,氟洗液中添加 Al3+的作用是___________ 。
(4)“反萃取”步骤中发生反应的离子方程式为___________ 。
(5)CeO2是汽车尾气净化催化剂的关键成分,在尾气消除过程中发生着 CeO2与 CeO2(1-x) (0≤x≤0.25)的相互转化。写出CeO2消除CO尾气的化学方程式:___________ 。
(6)CeO2(1-x)中的 Ce为+3、+4 价,测定x的值可判断它们的比例。现取CeO2(1-x)固体0.8280 g,加入足量硫酸和0.0110 mol FeSO4·7H2O充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①x的值为___________ 。
②若加入的 FeSO4·7H2O部分变质,会导致测定的 x 值___________ (填“偏高”“偏低”或“不变”)。

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。③Ce4+ 能被萃取剂 TBP 萃取,而Ce3+ 不能。回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)氧化焙烧后的固体产物中含有 CeO2和 CeF4物质的量之比为 3:1,“酸浸”时发生反应的离子方程式为
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP
 CeTBP4++F-,氟洗液中添加 Al3+的作用是
CeTBP4++F-,氟洗液中添加 Al3+的作用是(4)“反萃取”步骤中发生反应的离子方程式为
(5)CeO2是汽车尾气净化催化剂的关键成分,在尾气消除过程中发生着 CeO2与 CeO2(1-x) (0≤x≤0.25)的相互转化。写出CeO2消除CO尾气的化学方程式:
(6)CeO2(1-x)中的 Ce为+3、+4 价,测定x的值可判断它们的比例。现取CeO2(1-x)固体0.8280 g,加入足量硫酸和0.0110 mol FeSO4·7H2O充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①x的值为
②若加入的 FeSO4·7H2O部分变质,会导致测定的 x 值
您最近一年使用:0次
4 . 尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是________、_________。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。

(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g) H =+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为_____________。
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极。请写出阳极的电极反应方程为_____________。

请回答下列问题:
(1)操作I、II的名称分别是________、_________。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。

(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g) H =+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为_____________。
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极。请写出阳极的电极反应方程为_____________。

您最近一年使用:0次
名校
解题方法
5 . 氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为_______ 。
(2)反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) 在合成塔中进行。图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A. 0.6~0.7;B. 1~1.1;C. 1.5~1.61。生产中应选用水碳比的数值为_______ (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是_______ 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=_______ (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_______ %。

(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式_______ 。生产中可分离出的物质A的化学式为_______ 。

(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为
(2)反应2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) 在合成塔中进行。图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A. 0.6~0.7;B. 1~1.1;C. 1.5~1.61。生产中应选用水碳比的数值为
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为

(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式

您最近一年使用:0次
2016-12-09更新
|
356次组卷
|
6卷引用:2017届湖南省师大附中高三上月考三化学试卷



