名校
1 . 火箭使用的液体推进剂是偏二甲肼[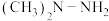 ,N为-2价]和
,N为-2价]和 ,发生化学反应:
,发生化学反应: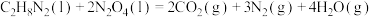 ,设
,设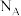 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
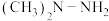 ,N为-2价]和
,N为-2价]和 ,发生化学反应:
,发生化学反应: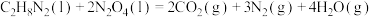 ,设
,设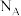 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.该反应的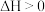 | B.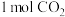 含有的共价键数为 含有的共价键数为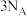 |
C. 的电子式为 的电子式为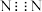 | D.消耗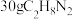 时,转移的电子数为 时,转移的电子数为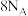 |
您最近一年使用:0次
名校
解题方法
2 . 实验室模拟用硫铁矿制备硫酸,其实验过程如图所示。下列说法正确的是

| A.硫铁矿的主要成分为FeS |
| B.“操作1”和“操作2”完全相同 |
C.S易溶于 是由于其为单原子分子,是非极性分子 是由于其为单原子分子,是非极性分子 |
D.每生成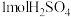 消耗 消耗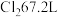 (标准状况) (标准状况) |
您最近一年使用:0次
名校
解题方法
3 . 用某复合金属作电极电解催化还原 时,复合金属优先与O原子结合,产物是HCOOH,复合金属优先与C原子结合,产物是
时,复合金属优先与O原子结合,产物是HCOOH,复合金属优先与C原子结合,产物是 和
和 。该反应机理及各产物的物质的量分数如图所示。下列说法正确的是
。该反应机理及各产物的物质的量分数如图所示。下列说法正确的是
 时,复合金属优先与O原子结合,产物是HCOOH,复合金属优先与C原子结合,产物是
时,复合金属优先与O原子结合,产物是HCOOH,复合金属优先与C原子结合,产物是 和
和 。该反应机理及各产物的物质的量分数如图所示。下列说法正确的是
。该反应机理及各产物的物质的量分数如图所示。下列说法正确的是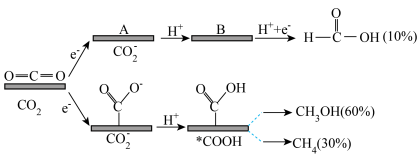
| A.过程中有极性键和非极性的断裂和形成 |
B.中间体B的结构简式为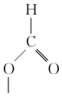 |
C. |
D.若有 完全转化,反应中转移的电子数为3.8mol 完全转化,反应中转移的电子数为3.8mol |
您最近一年使用:0次
4 . 利用某钒废渣(主要成分为V2O4以及铁、铝、硅的氧化物)制备V2O5的工艺流程如下: 溶于酸后以
溶于酸后以 的形式存在;
的形式存在; 可将
可将 氧化为
氧化为 ;
;
Ⅱ.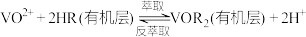 。
。
下列说法正确的是

 溶于酸后以
溶于酸后以 的形式存在;
的形式存在; 可将
可将 氧化为
氧化为 ;
;Ⅱ.
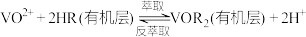 。
。下列说法正确的是
A.滤渣1的主要成分为 |
B. 的作用只是将 的作用只是将 氧化成 氧化成 |
| C.反萃取剂显强酸性 |
| D.“氧化2”中氧化剂与还原剂的物质的量之比为1∶3 |
您最近一年使用:0次
5 . 亚氯酸钠( )具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的
)具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的 易爆炸.下列说法错误的是
易爆炸.下列说法错误的是
 )具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的
)具有强氧化性、受热易分解,可用作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如图所示.已知高浓度的 易爆炸.下列说法错误的是
易爆炸.下列说法错误的是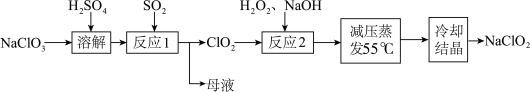
A.“反应1”中 是还原产物,母液中主要成分是 是还原产物,母液中主要成分是 |
B.“反应1”需要通入 稀释 稀释 ,以防发生爆炸 ,以防发生爆炸 |
C.“反应2”中,氧化剂和还原剂的物质的量之比为 |
D.若还原产物均为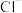 时, 时, 的氧化能力是等质量 的氧化能力是等质量 的2.5倍 的2.5倍 |
您最近一年使用:0次
名校
6 . 实验室可利用反应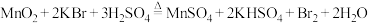 制备
制备 。设
。设 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是
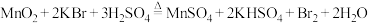 制备
制备 。设
。设 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是A.0℃、101kPa下,11.2L  所含的分子数为0.5 所含的分子数为0.5 |
B.0.1 的 的  溶液中含有的离子数为0.3 溶液中含有的离子数为0.3 |
C.常温常压下,9.8g  和9.8g 和9.8g  中含有的氧原子数均为0.4 中含有的氧原子数均为0.4 |
D.该反应中生成0.2mol  时,转移的电子数为0.2 时,转移的电子数为0.2 |
您最近一年使用:0次
名校
7 . “环境就是民生,青山就是美丽,蓝天也是幸福。”拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式___________ 。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:___________ 。
②过程Ⅱ为硝化过程,在微生物的作用下实现 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为___________ 。
③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→ →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为___________ 。
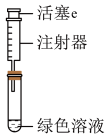
(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
①装置b、c、d中盛放的药品依次是___________ 、___________ 、___________ 。其中装置a中发生反应的化学方程式是___________ 。
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,___________ (填“操作”和“现象”),证实装置a中溶解了NO2。___________ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以
 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下: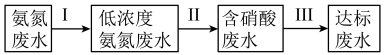
②过程Ⅱ为硝化过程,在微生物的作用下实现
 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→
 →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
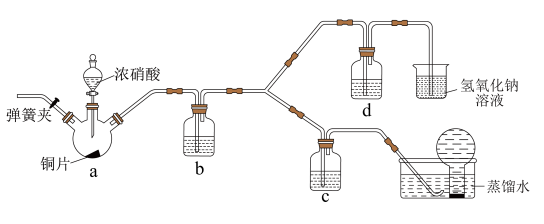
①装置b、c、d中盛放的药品依次是
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,
您最近一年使用:0次
解题方法
8 . 氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O①
2NO2+2NaOH=NaNO2+NaNO3+H2O②
在反应①中,氧化剂是___________ ,还原剂是___________ ,在反应②中,氧化剂和还原剂的物质的量之比为___________
(2)汽气车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为___________ 。
(3)由反应②判断二氧化氮是否为酸性氧化物(填“是”或“不是”)___________ ,原因是___________ 。
(4)目前有一种治理方法是在一定条件下用氨气将氮氧化物转化为无污染的物质,请写出氨气与二氧化氮反应的化学方程式:___________ ;该反应中,氧化剂是___________ ,氧化产物是___________ ,生成1.4mol氮气时,转移电子的物质的量为___________ 。
(5)为了保护环境,工业上常通入NH3使氮的氧化物和氨转化为无毒的N2。现有NO2和NO的混合气体3L,通入3L(同温同压下)NH3,恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为___________ 。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O①
2NO2+2NaOH=NaNO2+NaNO3+H2O②
在反应①中,氧化剂是
(2)汽气车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为
(3)由反应②判断二氧化氮是否为酸性氧化物(填“是”或“不是”)
(4)目前有一种治理方法是在一定条件下用氨气将氮氧化物转化为无污染的物质,请写出氨气与二氧化氮反应的化学方程式:
(5)为了保护环境,工业上常通入NH3使氮的氧化物和氨转化为无毒的N2。现有NO2和NO的混合气体3L,通入3L(同温同压下)NH3,恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为
您最近一年使用:0次
名校
9 . 硅单质及其化合物应用广泛。请回答下列问题:
(1) 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)___________ 。
(2)硅单质可作为硅半导体材料。三氯甲硅烷( )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图:
石英砂 粗硅
粗硅
 (粗)
(粗)
 (纯)
(纯) 高纯硅
高纯硅
①写出制粗硅的化学方程式___________ 。
②整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式___________ 。
(3)新型陶瓷材料氮化硅( )可应用于原子反应堆,一种制备氮化硅的反应为:
)可应用于原子反应堆,一种制备氮化硅的反应为:
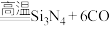 。若生成标准状况下33.6L CO时,反应过程中转移的电子数为
。若生成标准状况下33.6L CO时,反应过程中转移的电子数为___________  。
。
(1)
 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)(2)硅单质可作为硅半导体材料。三氯甲硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图:石英砂
 粗硅
粗硅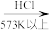
 (粗)
(粗)
 (纯)
(纯) 高纯硅
高纯硅①写出制粗硅的化学方程式
②整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式(3)新型陶瓷材料氮化硅(
 )可应用于原子反应堆,一种制备氮化硅的反应为:
)可应用于原子反应堆,一种制备氮化硅的反应为:
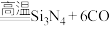 。若生成标准状况下33.6L CO时,反应过程中转移的电子数为
。若生成标准状况下33.6L CO时,反应过程中转移的电子数为 。
。
您最近一年使用:0次
名校
10 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.32g  中所含共价键数目为 中所含共价键数目为 |
B.0.1  溶液中所含 溶液中所含 数目少于0.1 数目少于0.1 |
C.标准状况下,22.4L  溶于足量NaOH溶液中,转移电子数目为2 溶于足量NaOH溶液中,转移电子数目为2 |
D.将10g铁粉加入稀硝酸中,最终有4.4g铁未溶解,该过程中转移电子数目为0.3 |
您最近一年使用:0次



