名校
解题方法
1 . 硝酸铈(Ⅳ)铵的化学式为(NH4)2Ce(NO3)6,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验步骤进行制备。
步骤一:先制备NH4HCO3溶液,再与CeCl3溶液反应制备难溶于水的Ce2(CO3)3,制备装置图如下:
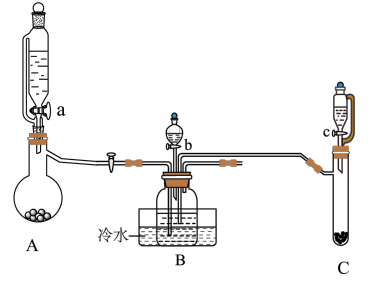
(1)装置A、C中相同仪器的名称为______ ,装置B中分液漏斗盛装的试剂是______ ,冷水浴的作用是______ 。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为______ 。装置B中发生反应的离子方程式有______ 、______ 。
(3)该实验装置存在的一处缺陷为______ 。
步骤二:取用制取的Ce2(CO3)3固体,先加硝酸溶解,再加入氨水调节溶液的pH生成氢氧化铈(Ⅳ)沉淀,过滤后在滤渣中加入浓硝酸和硝酸铵,就析出硝酸铈(Ⅳ)铵晶体。
(4)沉淀氢氧化铈(Ⅳ)的总反应离子方程式为______ 。
(5)硝酸铈(Ⅳ)铵晶体洗涤后要采取自然干燥的原因为______ 。
步骤一:先制备NH4HCO3溶液,再与CeCl3溶液反应制备难溶于水的Ce2(CO3)3,制备装置图如下:

(1)装置A、C中相同仪器的名称为
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:取用制取的Ce2(CO3)3固体,先加硝酸溶解,再加入氨水调节溶液的pH生成氢氧化铈(Ⅳ)沉淀,过滤后在滤渣中加入浓硝酸和硝酸铵,就析出硝酸铈(Ⅳ)铵晶体。
(4)沉淀氢氧化铈(Ⅳ)的总反应离子方程式为
(5)硝酸铈(Ⅳ)铵晶体洗涤后要采取自然干燥的原因为
您最近一年使用:0次
名校
2 . 某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:

已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2→2CuO+TeO2
(1)在整个流程的反应中涉及到______ 种单质。
(2)煅烧时,Cr2O3发生反应的化学方程式为______ 。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有______ (填化学式),写出生成TeOSO4的离子方程式______ 。
(4)“还原”步骤生成碲单质的离子方程式为______ ,得到的粗碲经洗涤后可以得到较为纯净的碲单质,检验碲单质是否洗涤干净的实验操作:______ 。

已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2→2CuO+TeO2
(1)在整个流程的反应中涉及到
(2)煅烧时,Cr2O3发生反应的化学方程式为
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有
(4)“还原”步骤生成碲单质的离子方程式为
您最近一年使用:0次
3 . 化学基本概念和研究方法要准确掌握,下列是某同学对有关物质进行分类的列表:
(1)上述三组分类中的错误物质有______ 种。
(2)砷是与磷相邻同主族元素,则其在周期表的位置是______ ;砷化氢的电子式:______ ,它是一种有剧毒恶臭的无色气体,还原性极强,能与硝酸银反应生成Ag和砒霜(As2O3),反应的离子方程式为______ 。
(3)已知: ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出______ 克I2(小数点后保留2位)。
(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是______ 。
(5)依据化学方程式,回答下列问题: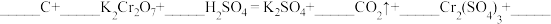
①配平完善化学方程式:_______________ 。
②H2SO4在上述反应中表现出来的性质是______ 。
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______ L。
| 组序号 | 单质 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| ① | 灰砷(α-As) | Na2CO3 | H2C2O4 | K2SO4 | Na2O2 | SO3 |
| ② | 臭氧 | Fe(OH)3胶体 | H37Cl | KAl(SO4)2 | CaO | As2O3 |
| ③ | I2 | Al(OH)3 | CH3OH | K2Cr2O7 | Al2O3 | NO2 |
(2)砷是与磷相邻同主族元素,则其在周期表的位置是
(3)已知:
 ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是
(5)依据化学方程式,回答下列问题:
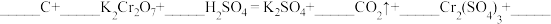
①配平完善化学方程式:
②H2SO4在上述反应中表现出来的性质是
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
解题方法
4 . 低品位铜矿(主要含CuS、FeO)提铜是解决我国铜产量低这一问题的重要技术,利用低品位铜矿制备Cu2O的一种工艺流程如下图所示:

已知:Ⅰ.MnCO3难溶于水,CuS难溶于水及强酸。
Ⅱ.Cu2O是一种难溶于水的红色物质。
回答下列问题:
(1)“溶浸”包括以下操作:研磨、混合、加热并搅拌、冷却、______ 。“溶浸”中MnO2的作用是______ 。
(2)检验“溶浸”后所得溶液中是否含有 的试剂是
的试剂是______ 。
(3)“调pH”后判断 是否完全沉淀的操作是
是否完全沉淀的操作是______ 。
(4)“还原”中还原产物与氧化产物的物质的量之比为______ 。
(5)将Cu2O固体加入过量稀硫酸中,溶液变成蓝色,且仍有红色固体存在,发生反应的离子方程式为______ 。
(6)有人提出“将低品位铜矿灼烧后用酸溶解制得铜盐”的工艺流程,该流程不足之处有______ (写出一项即可)。

已知:Ⅰ.MnCO3难溶于水,CuS难溶于水及强酸。
Ⅱ.Cu2O是一种难溶于水的红色物质。
回答下列问题:
(1)“溶浸”包括以下操作:研磨、混合、加热并搅拌、冷却、
(2)检验“溶浸”后所得溶液中是否含有
 的试剂是
的试剂是(3)“调pH”后判断
 是否完全沉淀的操作是
是否完全沉淀的操作是(4)“还原”中还原产物与氧化产物的物质的量之比为
(5)将Cu2O固体加入过量稀硫酸中,溶液变成蓝色,且仍有红色固体存在,发生反应的离子方程式为
(6)有人提出“将低品位铜矿灼烧后用酸溶解制得铜盐”的工艺流程,该流程不足之处有
您最近一年使用:0次
5 . 湿法制备多功能水处理剂K2FeO4固体的工艺流程如下:
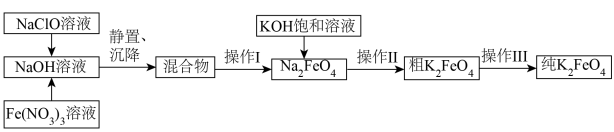
已知:NaCl、NaNO3在强碱中溶解度远小于Na2FeO4。
下列说法正确的是

已知:NaCl、NaNO3在强碱中溶解度远小于Na2FeO4。
下列说法正确的是
| A.溶解度:K2FeO4大于Na2FeO4 |
| B.“操作Ⅱ”所得副产物可循环使用 |
| C.“操作Ⅰ、Ⅱ、Ⅲ”都要使用的玻璃仪器有漏斗、玻璃棒、烧杯、酒精灯 |
D.生成Na2FeO4的离子方程式为 |
您最近一年使用:0次
名校
6 . Na2O2用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备Na2O2并检验其纯度的实验流程如图所示。

回答下列问题:
(1)生成Na2O2的化学方程式为___________ 。
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为___________ 。
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是___________ ,为防止Na2O2样品中含有的杂质生成需对空气进行预处理,预处理的措施是___________ 。
(4)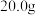 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为________ 。

回答下列问题:
(1)生成Na2O2的化学方程式为
(2)样液中加入MnO2后产生一种无色无味的气体单质,该气体的名称为
(3)已知白色沉淀为BaCO3,生成该沉淀的化学方程式是
(4)
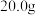 Na2O2样品可消耗
Na2O2样品可消耗 的BaCl2溶液
的BaCl2溶液 ,该样品的纯度为
,该样品的纯度为
您最近一年使用:0次
2023-08-10更新
|
236次组卷
|
6卷引用:山东省实验中学2022-2023学年高一上学期10月月考化学试题
名校
解题方法
7 . 对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是___________ (填序号,下同),既不属于电解质也不属于非电解质的是___________ 。
(2)向④中逐滴滴加⑦,可观察到的现象是___________ 。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
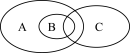
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是___________ (填字母)。
(4)写出物质③和⑦发生反应的离子方程式:___________ 。
(5)写出上述物质用于焊接钢轨的化学方程式:___________ 。
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:___________ 。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是
(2)向④中逐滴滴加⑦,可观察到的现象是
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(4)写出物质③和⑦发生反应的离子方程式:
(5)写出上述物质用于焊接钢轨的化学方程式:
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:
您最近一年使用:0次
2023-08-10更新
|
138次组卷
|
2卷引用:山东省实验中学2022-2023学年高一上学期12月月考化学试题
解题方法
8 .  是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为
是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为 )为原料制备
)为原料制备 的方法如图所示:
的方法如图所示:
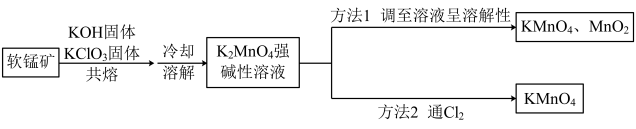
回答下列问题:
(1)共熔时能否用瓷坩埚做反应器___________ (填“能”或“否”)。
(2)方法1调至溶液呈弱碱性时反应的离子方程式为___________ 。
(3)方法2通 制备
制备 的装置如下图所示(夹持装置略):
的装置如下图所示(夹持装置略):
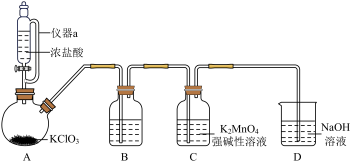
①仪器a的名称为___________ 。
②装置B中盛放的试剂为___________ (填试剂名称)。
③强碱性条件下,氧化性:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
④D中反应的离子方程式为___________ 。
 是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为
是一种常见的氧化剂和消毒剂,以软锰矿(主要成分为 )为原料制备
)为原料制备 的方法如图所示:
的方法如图所示:
回答下列问题:
(1)共熔时能否用瓷坩埚做反应器
(2)方法1调至溶液呈弱碱性时反应的离子方程式为
(3)方法2通
 制备
制备 的装置如下图所示(夹持装置略):
的装置如下图所示(夹持装置略):
①仪器a的名称为
②装置B中盛放的试剂为
③强碱性条件下,氧化性:

 (填“
(填“ ”或“
”或“ ”)。
”)。④D中反应的离子方程式为
您最近一年使用:0次
9 . 元素X、Y、Z、M、N、R均为短周期主族元素,且原子序数依次增大。X与Y可形成原子个数比为 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
(1)R在元素周期表中的位置为___________ 。
(2)R、Z、M、N的简单离子半径由大到小的顺序为___________ 。(填离子符号)。
(3)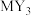 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为___________ 。
(4)M、N的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5)A能与B反应生成无毒气体,该反应的化学方程式为___________ 。
 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:(1)R在元素周期表中的位置为
(2)R、Z、M、N的简单离子半径由大到小的顺序为
(3)
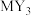 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为(4)M、N的最高价氧化物对应的水化物反应的离子方程式为
(5)A能与B反应生成无毒气体,该反应的化学方程式为
您最近一年使用:0次
10 . 科学家发现某些生物酶体系可以促进 和
和 的转移,能将海洋中的
的转移,能将海洋中的 转化为
转化为 进入大气层,反应过程如图所示。下列说法错误的是
进入大气层,反应过程如图所示。下列说法错误的是

 和
和 的转移,能将海洋中的
的转移,能将海洋中的 转化为
转化为 进入大气层,反应过程如图所示。下列说法错误的是
进入大气层,反应过程如图所示。下列说法错误的是
A.过程I为: |
B.过程II中参与反应的NO和 的物质的量之比为 的物质的量之比为 |
C.过程III中 发生还原反应 发生还原反应 |
D.过程I→III的总反应为: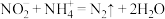 |
您最近一年使用:0次



